नमस्कार दोस्तों ! आज की इस पोस्ट में हम आपके लिए लेकर आये है विज्ञान का महत्वपूर्ण Chapter – 2 अम्ल क्षारक लवण (Acid Base Salts) के बारे में जानकारी दी गयी है | अम्ल, क्षारक, अम्ल के गुणधर्म, क्षारक के गुणधर्म, सूचक , गंधीय सूचक, PH Scale व कुछ प्राकृतिक अम्ल, लवण, विरंजक चूर्ण , बैंकिंग सोडा ,धोने का सोडा, क्रिस्टलन का जल व प्लास्टर ऑफ पेरिस आदि कक्षा 10 वी की परीक्षा में आने वाले महत्वपूर्ण टॉपिक है |
अम्ल (Acid)
Defination of Acid – वे पदार्थ जो जलीय विलयन में H + आयन देते हैं अम्ल कहलाते हैं |
अम्ल के गुणधर्म (Properties of Acid)
- अम्ल जलीय विलयन में H + आयन देते हैं |
- अम्ल नीले लिटमस पत्र को लाल कर देते हैं |
- अम्ल का PH मान सात से कम होता है |
- अम्ल स्वाद में खट्टे होते हैं |
Example –
Hcl, HNO3, H2SO4 (रसायनों का राजा)
CH3COOH (एसिटिक अम्ल)
H2O + HCl → H+ + Cl –
क्षारक (Bases)
Defination of Bases – वे पदार्थ जो जलीय विलयन में OH– आयन देते हैं क्षारक कहलाते हैं |
क्षारक के गुणधर्म (Properties of Bases)
- क्षारक जलीय विलयन में OH– आयन देते हैं |
- क्षारक लाल लिटमस पत्र को नीला कर देते हैं |
- क्षारक का PH मान 7 से अधिक होता है |
- क्षारक स्वाद में कड़वे होते है |
NOTE – वे क्षारक जो जल में घुलनशील होते हैं उन्हें क्षार कहते हैं सभी क्षारक, क्षार नहीं होते, सभी क्षार, क्षारक होते हैं |
सूचक
ऐसे पदार्थ जिनका रंग अम्लीय व क्षारीय माध्यम में बदल जाता है ऐसे पदार्थों को सूचक कहते हैं |
Example –
प्राकृतिक सूची – हल्दी, लिटमस , गुड़हल की पंखुड़ियां
संश्लेषित सूची – मेथिल ऑरेंज, फिनोफ्थलीन
गंधीय सूचक
ऐसे पदार्थ जिनकी गंध अम्लीय व क्षारीय माध्यम में बदल जाती है ऐसे पदार्थों को गंधीय सूचक कहते हैं |
Example – लौग का तेल, वेनिका, प्याज आदि
→ धातु की क्रिया अम्ल एवं क्षारक से –
धातु + अम्ल → लवण + H2
Zn + H2SO4 → ZnSo4 + H2
Fe + H2SO4 → FeSo4 + H2
धातु + क्षारक → लवण + H2
Zn + 2NaOH → Na2ZnO2 + H2
दानेदार जिंक (Zn) के टुकड़ों के साथ तनु सल्फ्यूरिक अम्ल ( H2SO4) की अभिक्रिया एवं ज्वलन द्वारा हाइड्रोजन गैस (H2) की जांच –
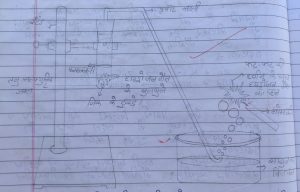
→ धातु कार्बोनेट एवं धातु हाइड्रोजन कार्बोनेट की क्रिया अम्लो के साथ –
धातु कार्बोनेट + अम्ल → लवण + H2o + Co2
Na2Co3 + 2HCl → 2NaCl + H2o + Co2
धातु हाइड्रोजन कार्बोनेट + अम्ल → लवण + H2o + Co2
Na HCo3 + HCl → NaCl + H2o + Co2
- इस रासायनिक अभिक्रिया में उत्पन्न CO2 गैस को चुने के पानी में प्रवाहित करने पर श्वेत अवक्षेप (कैलशियम कार्बोनेट) का निर्माण होता है |
- कैल्शियम कार्बोनेट के विभिन्न रूप जैसे खड़िया, चौक, संगमरमर, चुना पत्थर आदि |
Ca(OH)2 + CO2 → CaCo3 + H2o
- अधिक देर तक चुने के पानी {Ca(OH)2 } में कार्बन डाइऑक्साइड (CO2 ) गैस प्रवाहित करने पर कैल्शियम बाई कार्बोनेट {Ca(HCo3)2} का निर्माण होता है |
CaCo3 + H2o + CO2 → Ca(HCo3)2
- कैल्शियम बाई कार्बोनेट {Ca(HCo3)2} जब कार्बन डाइऑक्साइड (CO2 ) के सम्पर्क में आता है तो कैल्शियम कार्बोनेट (CaCo3) का निर्माण होता है |
Ca(OH)2 + CO2 → CaCo3 + H2o
कैल्शियम हाइड्रोक्साइड में से CO2 का गुजरना –
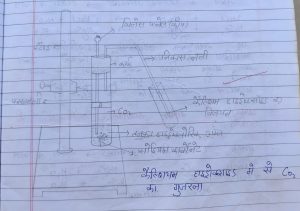
→ अम्ल एवं क्षारक परस्पर कैसे अभिक्रिया करते हैं –
उदासीनीकरण अभिक्रिया (Neutralization Reaction)
Defination of Neutralization Reaction – वह रासायनिक अभिक्रिया जिसमे अम्ल एवं क्षारक परस्पर अभिक्रिया करके लवण व जल का निर्माण करते हैं उदासीनीकरण अभिक्रिया कहलाती है |
अम्ल + क्षारक → लवण + जल
Hcl + NaOH → NaCl + H2o
H2SO4 + 2KOH → K2SO4 + H2o
→ अम्लो के साथ धात्विक ऑक्साइड की अभिक्रिया –
अम्ल + धात्विक ऑक्साइड → लवण + जल
2Hcl + Na2O → 2NaCl + H2o
H2SO4 + MgO → MgSO4 + H2o
→ यह रसायनिक अभिक्रिया उदासीनीकरण अभिक्रिया के समान है जिसमें अम्ल व क्षारक क्रिया करके लवण + जल बनाते हैं अतः धात्विक ऑक्साइड क्षारकीय प्रकृति के होते हैं
→ क्षारकों के साथ अधात्विक ऑक्साइड की अभिक्रिया –
क्षारक + अधात्विक ऑक्साइड → लवण + जल
2NaOH + CO2 → Na2Co3 + H2o
2KOH + So3 → K2So4 + H2o
→ यह रासायनिक अभिक्रिया उदासीनीकरण अभिक्रिया के समान है जिसमें अम्ल व क्षारक क्रिया करके लवण + जल बनाते हैं अतः अधात्विक ऑक्साइड अम्लीय प्रकृति के होते हैं |
→ अम्ल व क्षारक की परस्पर समानताएं –
- अम्ल जलीय विलयन में H + आयन देते हैं |
- जल में अम्ल का विलयन विद्युत चालन करता है |

एक कोर्क पर दो कीले लगाकर कोर्क को 100ml के बीकर में रख लीजिए चित्र के अनुसार कीलो को 6 वोल्ट की एक बैटरी के दोनों टर्मिनलो के साथ एक बल्ब तथा स्विच के साथ जोड़ देते हैं |
अब जलीय विलयन में थोड़ा अम्लीय पदार्थ जैसे हाइड्रोक्लोरिक अम्ल (HCl) डालकर विद्युत धारा प्रवाहित करते हैं तो हम पाते हैं कि बल्ब दीप्तिमान हो जाता है क्योंकि अम्लीय पदार्थ जलीय विलयन में H + आयन देते हैं |
अगर हम जलीय विलयन में क्षारीय पदार्थ जैसे सोडियम हाइड्रोक्साइड (NaOH) डालते हैं तो बल्ब दीप्तिमान नहीं होता क्योंकि क्षारीय पदार्थ जलीय विलयन में OH – आयन देते हैं |
Question – जलीय विलयन में अम्ल प्रवाहित करने से बल्ब दीप्तिमान हो जाता जलीय विलयन है जबकि में क्षारक डालने से बल्ब दीप्तिमान नहीं होता स्पष्ट कीजिए ?
Answer – अम्ल जलीय विलयन में H + आयन देता है इस कारण बल्ब दीप्तिमान हो जाता है, जबकि क्षारक जलीय विलयन में OH – आयन देते हैं इस कारण बल्ब दीप्तिमान नहीं होता है |
→ जलीय विलयन में अम्ल व क्षारक की क्रिया –
अम्ल जलीय विलयन H+ आयन
Example –
Hcl जलीय विलयन H+ + Cl–
H2So4 जलीय विलयन 2H+ + So4 -2
CH3COOH जलीय विलयन CH3COO– + H+
HNO3 जलीय विलयन H+ + NO3–
Hcl + H2o जलीय विलयन H3O + + Cl–
क्षारक जलीय विलयन OH- आयन
KOH जलीय विलयन K+ + OH–
NaOH जलीय विलयन Na+ + OH–
Mg(OH)2 जलीय विलयन Mg+2 + OH–
Ca(OH)2जलीय विलयन Ca+2 + 2OH–
Fe(OH)3जलीय विलयन Fe+3 + 3OH–
Al(OH)3 जलीय विलयन Al+3 + 3OH–
तनुकरण (Dilution)
Defination of Dilution – जल में अम्ल व क्षारक मिलाने पर आयन की सांद्रता (H+/OH- ) में प्रति इकाई आयतन में कमी हो जाती है इस प्रक्रिया को तनुकरण कहते हैं |
→ अम्ल व क्षारक प्रबल व दुर्बल –
PH स्केल में P शब्द जर्मन शब्द पूसास से बना होता है जिसका अर्थ होता है – शक्ति और H+ का अर्थ – हाइड्रोजन आयन की सांद्रता
इसमें H+ आयन की सांद्रता को एक स्केल के द्वारा विकसित करते हैं जिसे पीएच स्केल कहते है |
1. दुर्बल अम्ल (Weak Acid)
वह विलयन जिसमें H+ आयन की सांद्रता कम होती है उस विलयन को दुर्बल अम्ल कहते हैं |
2. प्रबल अम्ल (Strong Acid)
अधिक संख्या में H+ आयन उत्पन्न करने वाले अम्ल प्रबल अम्ल कहलाते हैं |
3. दुर्बल क्षारक (Weak Bases)
कम संख्या में OH – आयन उत्पन्न करने वाले क्षारक दुर्बल क्षारक कहलाते हैं |
4. प्रबल क्षारक (Strong Bases)
अधिक संख्या में OH – आयन उत्पन्न करने वाले क्षारक प्रबल क्षारक कहलाते हैं |
PH Scale
- यदि पीएच का मान 7 से कम होता है उसे अम्लीय विलयन कहते हैं |
- यदि पीएच का मान 7 के बराबर होता है उसे उदासीन विलयन कहते हैं |
- यदि पीएच का मान 7 से अधिक होता है तो उसे क्षारीय विलयन कहते हैं |
Note :- PH पैमाने की खोज 1909 में सोरेन्सन नामक वैज्ञानिक ने की थी
- नींबू के रस का PH मान – 2.2
- जठर रस का PH मान – 1.2
- शुद्ध जल का पीएच मान 7 रक्त का PH मान – 7.4
- मिल्क ऑफ मैग्नीशिया / Mg(OH)2 (रेनटेक) का PH मान – 10
- सोडियम हाइड्रोक्साइड (NaOH) का PH मान – 14
दैनिक जीवन में PH का महत्व
- पौधे एवं पशु PH के प्रति संवेदनशील होते हैं |
- हमारा शरीर 7.0 – 7.8 PH के बीच कार्य करता है |
अम्लीय वर्षा (Acid Rain)
- वर्षा के जल का PH मान जब 5.6 से कम हो जाता है तो वह अम्लीय वर्षा कहलाती है |
- अम्लीय वर्षा का जल जब नदी में प्रवाहित होता है तो नदी के जल का PH मान कम हो जाता है ऐसी नदी में जलीय जीव धारियों की उत्तरजीविता कठिन हो जाती है |
- मिट्टी के PH का मान 7 से कम होता है तो मिट्टी अम्लीय प्रकृति की हो जाती है इस अम्लीय प्रकृति को दूर करने के लिए बुझे हुए चूने का उपयोग किया जाता है |
हमारे पाचन तंत्र का PH मान
हमारा उधर हाइड्रोक्लोरिक अमल उत्पन्न करता है यह उधर को हानि पहुंचाए बिना भोजन के पाचन में सहायक होता है अपच की स्थिति में अत्यधिक मात्रा में अम्ल उत्पन्न करता है जिसके कारण उधर में जलन एवं दर्द का अनुभव होता है इस दर्द से मुक्त होने के लिए एंटी एसिड का उपयोग किया जाता है |
एंटी एसिड (Anti Acid)
एंटी एसिड दो शब्दों से मिलकर बना होता है Anti + Acid , Anti का अर्थ है – प्रति Acid का अर्थ है – अम्ल
PH परिवर्तन के कारण दन्तक्षय
मुंह में PH का मान 5.5 से कम होने पर दांतो का क्षय प्रारंभ हो जाता है | दांतो का इनेमल (दंतवल्क) कैल्सियम फास्फेट से बना होता है जो कि शरीर का सबसे कठोर पदार्थ है | यह जल में नहीं खुलता लेकिन मुंह का PH मान 5.5 से कम होने पर यह संक्षारित हो जाता है | मुंह में उपस्थित बैक्टीरिया भोजन के पश्चात मुंह में अवशिष्ट शर्करा एवं खाद्य पदार्थों का निम्नीकरण करके अम्ल उत्पन्न करते हैं | भोजन के बाद मुंह साफ करने से इससे बचाव किया जा सकता है | मुंह की सफाई के लिए क्षारकीय दंत मंजन का उपयोग करने से अम्ल की अधिक मात्रा को उदासीन किया जा सकता है | जिसके परिणाम स्वरूप दन्तक्षय को रोका जा सकता है |
कुछ प्राकृतिक अम्ल (Some Natural Acids)
- सिरका – एसिटिक अम्ल
- संतरा – सिट्रिक अम्ल
- इमली – टार्टरिक अम्ल
- टमाटर – ऑक्सेलिक अम्ल
- खट्टा दूध – लैक्टिक अम्ल
- नींबू – सीट्रिक अम्ल
- चिटी का डंक – मेथेनॉइक अम्ल
- नेटल का डंक – मेथेनॉइक अम्ल
Question – पशु एवं पौधो के द्वारा उत्पन्न रसायनों से आत्मरक्षा कैसे करते हैं ?
Answer – मधुमक्खी का डंक एक अम्ल छोड़ता है जिसके कारण दर्द एवं जलन का अनुभव होता है डंक मारे गए अंग में बैंकिंग सोडा जैसे दुर्बल क्षारक के उपयोग से आराम मिलता है नेटल के डंक वाले बाल मेथेनॉइक अम्ल छोड़ देते हैं जिसके कारण जलन व दर्द का अनुभव होता है |
लवण (Salt)
Defination of Salt- जब धातु की क्रिया अम्लो से करवाते हैं तो अम्लो के अपशिष्ट धातु से मिलकर एक यौगिक का निर्माण करते हैं उस यौगिक को लवण कहते हैं |
लवण परिवार (Salt Family)
1. क्लोर क्षार अभिक्रिया (Chlor Alkali Reaction)
वह रासायनिक अभिक्रिया जिसमें सोडियम क्लोराइड के जलीय विलयन में विद्युत धारा प्रवाहित करने पर सोडियम हाइड्रोक्साइड व क्लोरीन गैस का निर्माण होता है इस अभिक्रिया को क्लोर क्षार अभिक्रिया कहते हैं |
Reaction –
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. विरंजक चूर्ण (Bleaching Powder)
बुझे हुए चूने पर क्लोरीन गैस की क्रिया से विरंजक चूर्ण का निर्माण होता है |
Reaction –
Ca(OH)2 + Cl2 → CaOCl2 + H2O
विरंजक चूर्ण का उपयोग (Use of Bleaching Powder)
- वस्त्र उद्योग में सूती एवं लीलेन के विरंजन में,
- कागज की फैक्ट्री में,
- लकड़ी के मज्जा एवं लाउंड्री में साफ कपड़ों के विरंजन के लिए,
- कई रासायनिक उद्योगों में एक उपचायक के रूप में,
- पीने वाले जल को जीवाणुओं से मुक्त करने के लिए रोगाणुनाशक के रूप में |
3. बैंकिंग सोडा (Banking Soda)
- सोडा का उपयोग आमतौर पर रसोई घर में स्वादिष्ट खस्ता पकोड़े बनाने के लिए किया जाता है |
- कभी–कभी इसका उपयोग खाने को शीघ्रता से पकाने के लिए भी किया जाता है |
- इस योगिक का नाम सोडियम हाइड्रोजन कार्बोनेट (NaHCo3) है |
- कच्चे पदार्थों में सोडियम क्लोराइड का उपयोग कर सोडियम हाइड्रोजन कार्बोनेट (NaHCo3) निर्माण किया जाता है |
Reaction –
NaCl + H2O + Co2 + NH3 → NH4Cl + NaHCo3
यह एक दुर्बल असंक्षारक क्षारक है खाना पकाते समय इसे गर्म करने पर निम्न अभिक्रिया होती है –
Reaction –
2NaHCo3 → Na2Co3 + H2O + Co2
सोडियम हाइड्रोजन कार्बोनेट (NaHCo3) का उपयोग
- बेकिंग पाउडर बनाने में जो बैंकिंग सोडा एवं टार्टरिक अम्ल जैसा एक मंद खाद्य अम्ल का मिश्रण है | जब बेकिंग पाउडर को गर्म किया जाता है या जल में मिलाया जाता है तो निम्न अभिक्रिया होती है
Reaction –
NaHCo3 + H+ → H2O + Co2 + अम्ल का सोडियम लवण
- इस अभिक्रिया से उत्पन्न कार्बन डाइऑक्साइड के कारण पावरोटी या केक में खमीर उठ जाता है तथा इससे यह मुलायम एवं स्पंजी हो जाता है |
- सोडियम हाइड्रोजन कार्बोनेट भी एंटी एसिड का एक संघटक है क्षारीय होने के कारण यह पेट में अम्ल की अधिकता को उदासीन करके राहत पहुंचाता है |
- इसका उपयोग सोडा अम्ल अग्निशामक में भी किया जाता है |
4. धोने का सोडा (Washing Soda)
- धोने का सोडा (Na2Co3 .10H2O) एक अन्य रसायन जिसे सोडियम क्लोराइड से प्राप्त किया जा सकता है |
- बेकिंग सोडा को गर्म करके सोडियम कार्बोनेट प्राप्त किया जा सकता है |
- सोडियम कार्बोनेट के पुनः क्रिस्टलीकरण से धोने का सोडा प्राप्त होता है |
- धोने का सोडा भी एक क्षारकीय लवण है |
Reaction –
Na2Co3 + 10H2O → Na2Co3 .10H2O
धोने के सोडे के उपयोग (Use of Washing Soda)
- सोडियम कार्बोनेट का उपयोग कांच साबुन एवं कागज उद्योग में होता है |
- धोने के सोडे का उपयोग बोरेक्स जैसे सोडियम योगिक के उत्पादन में होता है |
- सोडियम कार्बोनेट का उपयोग घरों में साफ–सफाई के लिए होता है |
- जल की स्थाई कठोरता को हटाने के लिए भी इसका उपयोग होता है |
5. क्रिस्टल का जल (Crystal Water)
लवण के एक सूत्र इकाई में जल के निश्चित अणुओं की संख्या को क्रिस्टलन का जल कहते हैं |
Example –
(i) Na2Co3 .10H2O = 10
(ii) CuSo4 . 5H2O = 5
(iii) FeSo4 . 7H2O = 7
(iv) CaSo4 .2H2O = 2
6. प्लास्टर ऑफ पेरिस (Plaster of Paris / POP)
जिप्सम को 373 केल्विन पर गर्म करने पर यह जल के अणु का त्याग कर कैलशियम सल्फेट अर्धहाइड्रेट / हेमीहाइड्रेट (CaSo4 .1/2H2O) बनाता है इसे प्लास्टर ऑफ पेरिस कहते हैं |
- इस पदार्थ का उपयोग डॉक्टर टूटी हुई हड्डियों को सही जगह पर स्थिर रखने के लिए करते हैं |
- प्लास्टर ऑफ पेरिस एक सफेद चूर्ण है जो जल में मिलाने पर यह पुनः जिप्सम (CaSo4 .2H2O) बनकर कठोर ठोस पदार्थ प्रदान करता है |
Reaction –
CaSo4 .1/2H2O + 3/2H2O → CaSo4 .2H2O
उपरोक्त पोस्ट में Chapter – 2 अम्ल क्षारक लवण (Acid Base Salts) के बारे में विस्तृत जानकारी दी हुई है | इसके अतिरिक्त अगर आप विज्ञान के और भी अध्यायों का अध्यन करना चाहे तो आप हमारी वेबसाइट पर कर सकते है कुछ महत्वपूर्ण लिंक निचे दिए है |
Important FAQs
Question 1. चींटी के डंक में कौन सा अम्ल होता है ?
Answer – मेथेनॉइक अम्ल
Question 2. अम्लीय प्रवृत्ति में PH का मान कितना होता है
Answer – 7 से कम
Question 3. क्षारीय प्रवृत्ति में PH का मान कितना होता है
Answer – 7 से अधिक
Question 4. उदासीन प्रवृत्ति में PH का मान कितना होता है
Answer – 7 के बराबर
Question 5. मानव शरीर की PH परास कितनी होती है
Answer – 7.0 से 7.8
Question 6. अम्लीय वर्षा का PH मान कितना होता है
Answer – 5.6
Question 7. दंत क्षय PH मान कितना होता है?
Answer – 5.5
Question 8. नींबू के रस का PH मान कितना होता है?
Answer – 2.2
Question 9. जठर रस का PH मान कितना होता है?
Answer – 1.2
Question 10. शराब का PH मान कितना होता है?
Answer – 2.8
Question 11. टमाटर का PH मान कितना होता है?
Answer – 4.5
Question 12. दूध का PH मान कितना होता है?
Answer – 6.4
Question 13. सिरके का PH मान कितना होता है?
Answer – 3
Question 14. हाइड्रोक्लोरिक अमल (HCl) का PH मान कितना होता है?
Answer – 1
Question 15. अचार का PH मान कितना होता है?
Answer – 3.5
Question 16. सेब का PH मान कितना होता है?
Answer – 3
Question 17. पनीर का PH मान कितना होता है?
Answer – 5.9
Question 18. केले का PH मान कितना होता है?
Answer – 4.5 – 5.2
Question 19. रोटी का PH मान कितना होता है?
Answer – 5.3 – 5.8
Question 20. मूत्र का PH मान कितना होता है?
Answer – 4.8 – 8.4
Important Question
Question 21. शुद्ध जल का PH मान कितना होता है?.
Answer – 7
Question 22. नमक का PH मान कितना होता है?
Answer – 7
Question 23. शुद्ध रक्त का PH मान कितना होता है?
Answer – 7.4– 7.8
Question 24. समुद्री जल का PH मान कितना होता है?
Answer – 8.5
Question 25. मानव लार का PH मान कितना होता है?
Answer – 6.5 से 7.5
Question 26. NaCl का PH मान कितना होता है?
Answer – 7
Question 27. मानव शरीर के पाचन तंत्र का PH मान कितना होता है?
Answer – 7 से 7.8
Question 28. मिल्क ऑफ मैग्नीशिया (रेनटेक)का PH मान कितना होता है?
Answer – 10
Question 29. सोडियम हाइड्रोक्साइड (NaOH) का PH मान कितना होता है?
Answer – 14
Question 30. टमाटर में कौन सा अम्ल पाया जाता है ?
Answer – ऑक्जेलिक अम्ल
Very Important Question
Question 31. नेटल के डंक में कौन सा अम्ल होता है ?
Answer – मेथेनॉइक अम्ल
Question 32. नींबू में कौन सा एसिड पाया जाता है ?
Answer – सीट्रिक अम्ल
Question 33. संतरे में कौन सा अम्ल पाया जाता है ?
Answer – सिट्रिक अम्ल
Question 34. इमली में कौन सा अम्ल पाया जाता है ?
Answer – टार्टरिक अम्ल
Question 35. सिरके में कौन सा अम्ल होता है ?
Answer – एसिटिक अम्ल
Question 36. खट्टे दूध में कौन सा अम्ल पाया जाता है ?
Answer – लैक्टिक अम्ल
Question 37. अम्ल किसे कहते है ?
Answer – वे पदार्थ जो जलीय विलयन में H + आयन देते हैं अम्ल कहलाते हैं |
Question 38. क्षारक किसे कहते है ?
Answer – वे पदार्थ जो जलीय विलयन में OH– आयन देते हैं क्षारक कहलाते हैं |
Question 39. सूचक किसे कहते है ?
Answer – ऐसे पदार्थ जिनका रंग अम्लीय व क्षारीय माध्यम में बदल जाता है ऐसे पदार्थों को सूचक कहते हैं |
Question 40. तनुकरण किसे कहते है ?
Answer –जल में अम्ल व क्षारक मिलाने पर आयन की सांद्रता (H+/OH- ) में प्रति इकाई आयतन में कमी हो जाती है इस प्रक्रिया को तनुकरण कहते हैं
Question 41. लवण किसे कहते हैं ?
Answer – जब धातु की क्रिया अम्लो से करवाते हैं तो अम्लो के अपशिष्ट धातु से मिलकर एक यौगिक का निर्माण करते हैं उस यौगिक को लवण कहते हैं |
Question 42. बैंकिंग सोडे का रासायनिक सूत्र क्या होता है ?
Answer – NaHCo3
Question 43. धोने के सोडे का रसायनिक सूत्र क्या होता है ?
Answer – Na2Co3 .10H2O
Question 44. विरंजक चूर्ण का रासायनिक सूत्र क्या है ?
Answer – CaOCl2
Question 45. बैंकिंग सोडे को अन्य किस नाम से जाना जाता है ?
Answer – खाने का सोडा या मीठा सोडा
Question 46. जिप्सम का रासायनिक सूत्र क्या है ?
Answer – CaSo4 .2H2O
Other Topic Important Links
Science More Important Topics you can click here
Hindi More Important Topics you can read here
Rajasthan GK More Important Topics click here
Psychology More Important Topics you can read here
