नमस्कार दोस्तों ! आज की इस पोस्ट में हम आपके लिए लेकर आये है 10th Science Chapter 4 कार्बन एंव उसके यौगिक Notes in Hindi.
इस पोस्ट में विज्ञान के महत्वपूर्ण Chapter 4 कार्बन एंव उसके यौगिक Notes in Hindi के बारे में जानकारी दी गयी है | कार्बन, कार्बन के गुणधर्म, योगिक व हाइड्रोकार्बन, कार्बन, हाइड्रोकार्बन का नामकरण, एल्केन श्रेणी, एल्कीन श्रेणी व एल्काइन श्रेणी , क्रियात्मक समूह का IUPAC नामकरण , एल्कोहल, कार्बोक्सिलिक अम्ल, एल्डिहाइड, कीटोन व हैलोजन , अपरूप , क्रिस्टलीय अपरूप ,अक्रिस्टलीय अपरूप, हीरा, ग्रेफाइट व फुलेरीन, कार्बनिक यौगिकों के रासायनिक गुणधर्म, दहन,ऑक्सीकारक, संकलन अभिक्रिया व प्रतिस्थापन अभिक्रिया , एथेनॉल के गुणधर्म,एथेनॉल की अभिक्रिया, एथेनोइक अम्ल के गुणधर्म, एथेनोइक अम्ल की अभिक्रिया व एस्टरीकरण अभिक्रिया , साबुन,अपमार्जक व मिसेल निर्माण की क्रियाविधि आदि कक्षा 10 वी की परीक्षा में आने वाले महत्वपूर्ण टॉपिक है | यह टॉपिक कक्षा 10 वी साइंस का Chapter – 4 “कार्बन एंव उसके यौगिक ” से लिया गया है |
कार्बन (Carbon)
Defination of Carbon – Carbon (कार्बन) एक रसायनिक तत्व है, जिसका परमाणु क्रमांक 6 होता है तथा प्रतीक “C” होता है |
Properties of Carbon ( कार्बन के गुणधर्म )
1. कार्बन का प्रतीक – 6C12
Z = परमाणु क्रमांक , प्रोटोन संख्या = 6
A = द्रव्यमान संख्या = 12
N = न्यूट्रॉन की संख्या = A-Z = 12 – 6 = 6
2. कार्बन का इलेक्ट्रॉनिक विन्यास – 1s2, 2s2, 2p2
3. कार्बन में श्रंखलन की प्रवृत्ति पाई जाती है | तथा एक कार्बन दूसरे कार्बन से तथा दूसरा कार्बन तीसरे कार्बन से, तीसरा कार्बन चौथे कार्बन से इसी क्रम में जुड़े होते हैं, इसे श्रंखलन की प्रवृत्ति कहते है |
4. Carbon (कार्बन) चतुर्थ सयोजी अर्थात कार्बन की संयोजकता चार होती है |
5. कार्बन की संयोजकता के मध्य 109° 23″ का कोण पाया जाता है |
6. इसके मध्य एकल बंध, द्विबंध व त्रिबंध पाए जाते हैं |
7. Carbon (कार्बन) की मात्रा –
- भूपर्पटी में कार्बन की मात्रा – 0.02 %
- वायुमंडल में कार्बन की मात्रा – 0.03 %
योगिक (Compound)
Defination of Compound – दो या दो से अधिक तत्व, पदार्थ या परमाणु मिलकर योगिक का निर्माण करते है |
योगिक दो प्रकार के होते हैं –
(i) सम योगिक –
Example – H2, Cl2, F2, O2, N2
(ii) विषम योगिक –
Example – Co2, CO, HCl, NaCl
हाइड्रोकार्बन (Hydrocarbons)
Defination of Hydrocarbons – हाइड्रोजन व कार्बन से मिलकर बने योगिक को हाइड्रोकार्बन कहते हैं |
हाइड्रोकार्बन दो प्रकार के होते हैं –
1. अचक्रीय हाइड्रोकार्बन
2. चक्रीय हाइड्रोकार्बन
1. अचक्रीय हाइड्रोकार्बन (Acyclic Hydrocarbons)
Defination of Acyclic Hydrocarbons – वे हाइड्रोकार्बन जिसमें कार्बन परमाणु एक सीधी श्रृंखला के रूप में जुड़े होते हैं | इनमें प्रथम कार्बन अंतिम कार्बन से जुड़ा हुआ नहीं होता है, वह अचक्रीय हाइड्रोकार्बन कहलाता है |
Example – मेथेन, एथीन, प्रोपाइन
अचक्रिय हाइड्रोकार्बन दो प्रकार के होते हैं –
(i) संतृप्त हाइड्रोकार्बन
(ii) असंतृप्त हाइड्रोकार्बन
(i) संतृप्त हाइड्रोकार्बन (Saturated Hydrocarbons)
Defination of Saturated Hydrocarbons – वे अचक्रीय हाइड्रोकार्बन जिनके कार्बन परमाणुओं के मध्य एकल बंध पाया जाता है, वह संतृप्त हाइड्रोकार्बन कहलाते हैं |
उदाहरण –
एल्केन श्रेणी – एथेन, मेथेन
(ii) असंतृप्त हाइड्रोकार्बन (Unsaturated Hydrocarbons)
Defination of Unsaturated Hydrocarbons – वे अचक्रीय हाइड्रोकार्बन जिनके कार्बन परमाणुओं के मध्य द्विबंध व त्रिबंध पाए जाते हैं, उसे असंतृप्त हाइड्रोकार्बन कहते हैं |
उदाहरण –
एल्कीन श्रेणी – प्रोपीन, ब्यूटीन
एल्काइन श्रेणी – प्रोपाईन, ब्यूटाइन
2. चक्रीय हाइड्रोकार्बन (Cyclic Hydrocarbons)
Defination of Cyclic Hydrocarbons – वे हाइड्रोकार्बन जिनमें कार्बन परमाणु चक्र के रूप में जुड़े होते हैं | इसमें प्रथम व अंतिम परमाणु आपस में जुड़े होते हैं, उसे चक्रीय हाइड्रोकार्बन कहते हैं |
उदाहरण – बेंजीन, फिनोल, साइक्लोपेंटेन, साइक्लोप्रोपेन, साइक्लोहेक्सेन
चक्रीय हाइड्रोकार्बन दो प्रकार के होते हैं –
(i) विषम चक्रीय हाइड्रोकार्बन (ii) सम चक्रीय हाइड्रोकार्बन
(i) विषम चक्रीय हाइड्रोकार्बन –
Example – प्यूरीन, पीरिडिन, थायगीन
(ii) सम चक्रीय हाइड्रोकार्बन –
यह दो प्रकार के होते है
- एरोमेटिक – बेंजीन, फिनोल
- एलिसाइक्लिक – साइक्लोप्रोपीन, साइक्लोब्यूटेन, साइक्लोहेक्सेन
हाइड्रोकार्बन का नामकरण
पूर्वलग्न + अनुलग्न
1. पूर्वलग्न का निर्धारण कार्बन परमाणुओं की संख्या के आधार पर किया जाता है |
Prefixed (पूर्वलग्न)
C1 = मेथ
C2 = ऐथ
C3 = प्रॉप
C4 = ब्यूट
C5 = पेंन्ट
C6 = हेक्स
C7 = हेप्ट
C8 = ओक्ट
C9 = नोन
C10 = डेक
2. अनुलग्न का निर्धारण कार्बन व कार्बन परमाणुओं के बीच में पाए जाने वाले बंध के आधार पर किया जाता है |
| कार्बन परमाणु के मध्य बंध | अनुलग्न |
| एकल बंध (Single bond) C – C | ऐन |
| द्विबंध (Double bond) C = C | ईन |
| त्रिबंध (Triple bond) C ≡ C | आइन |
- पूर्वलग्न व अनुलग्न को जोड़कर हाइड्रोकार्बन का नामकरण किया जाता है |
कार्बन संख्या – पूर्वलग्न + अनुलग्न
C1 मेथ + ऐन
मेथेन
C2 ऐथ + ऐन
ऐथेन
श्रेणी (Series)
श्रेणी तीन प्रकार की होती है –
1. एल्केन श्रेणी (Alkane Series)
2. एल्कीन श्रेणी (Alkene Series)
3. एल्काइन श्रेणी (Alkyne Series)
1. एल्केन श्रेणी (Alkane Series)
- एल्केन श्रेणी का सामान्य सूत्र CnH2n+2 है |
- अनुलग्न एन का प्रयोग होता है |
- एल्केन में कार्बन के मध्य एकल बंध पाया जाता है |
- एल्केन श्रेणी में n का मान एक होता है |
- श्रेणी का प्रथम सदस्य मेथेन होता है |
Example –
(i) n = 1
CnH2n+2
C1H2×1+2 CH4
मेथ + ऐन मेथेन
(ii) n = 2
CnH2n+2
C2H2×2+2 C2H6
ऐथ + ऐन ऐथेन
- मेथेन में 4 सहसंयोजक बंध होते हैं |
- ऐथेन में 7 सहसंयोजक बंध होते हैं |
- प्रोपेन में 10 सहसंयोजक बंध होते हैं |
- ब्यूटेन में 13 सहसंयोजक बंध होते हैं |
- पेन्टेन में 16 सहसंयोजक बंध होते हैं |
- हेक्सेन में 19 सहसंयोजक बंध होते हैं |
- हेप्टेन में 22 सहसंयोजक बंध होते हैं |
2. एल्कीन श्रेणी (Alkene Series)
- एल्कीन श्रेणी का सामान्य सूत्र CnH2n है |
- अनुलग्न ईन का प्रयोग होता है |
- कार्बन के मध्य भी द्विबंध पाया जाता है |
- श्रेणी में कम से कम n का मान 2 होता है |
- प्रथम सदस्य एथीन होता है |
- एल्कीन के सदस्यों को ओलीफंन्स कहते हैं |
Example –
(i) n = 2
CnH2n
C2H2×2 C2H4
ऐथ + ईन एथीन
(ii) n = 3
CnH2n
C3H2×3 C3H6
प्रोप +ईन प्रोपीन
- एथीन में 6 सहसंयोजक बंध होते हैं |
- प्रोपीन में 9 सहसंयोजक बंध होते हैं |
- ब्युटीन में 12 सहसंयोजक बंध होते हैं |
- पेंटीन में 15 सहसंयोजक बंध होते हैं |
- हेक्सीन में 18 सहसंयोजक बंध होते हैं |
3. एल्काइन श्रेणी (Alkyne Series)
- एल्काइन श्रेणी का सामान्य सूत्र CnH2n-2होता है |
- अनुलग्न आइन का प्रयोग होता है |
- कार्बन कार्बन के मध्य त्रिबंध पाया जाता है |
- कम से कम n का मान 2 होता है |
- श्रेणी का प्रथम सदस्य ऐथाइन होता है |
- एल्काइन को एसिटिलीन भी कहा जाता है |
Example –
(i) n = 2
CnH2n-2
C2H2×2-2 C2H2
ऐथ+आइन ऐथाइन
(ii) n = 3
CnH2n-2
C3H2×3-2 C3H4
प्रोप+आइन प्रोपाइन
- ऐथाइन में 5 सहसंयोजक बंध होते हैं |
- प्रोपाइन में 8 सहसंयोजक बंध होते हैं |
- ब्युटाईन में 11 सहसंयोजक बंध होते हैं |
- पेन्टाइन में 14 सहसंयोजक बंध होते हैं |
- हेक्साइन में 17 सहसंयोजक बंध होते हैं |
- हेप्टाइन में 20 सहसंयोजक बंध होते हैं |
- ओक्टाइन में 23 सहसंयोजक बंध होते हैं |
क्रियात्मक समूह का IUPAC नामकरण
| क्रियात्मक समूह | नाम | अनुलग्न |
| -OH | एल्कोहल | ऑल |
| -COOH | कार्बोक्सिलिक अम्ल | ऑइक |
| -CHO | एल्डिहाइड | ऐल |
| -C=O | कीटोन | ऑन |
| F, Cl, Br, I | हैलोजन | पूर्वलग्न |
एल्कोहल का सामान्य सूत्र
CnH2n+2
अनुलग्न – ऑल (OH)
Example –
1. CH4O (मेथेनॉल)
मेथेनॉल मे 4 सहसंयोजक बंध होते हैं |
2. C2H6O (एथेनॉल)
एथेनॉल मे 7 सहसंयोजक बंध होते हैं |
3. C3H8O (प्रोपेनॉल)
प्रोपेनॉल मे 10 सहसंयोजक बंध होते हैं |
4. C4H10O (ब्यूटेनॉल)
ब्यूटेनॉल मे 13 सहसंयोजक बंध होते हैं |
5. C5H12O (पेंटेनॉल)
पेंटेनॉल मे 16 सहसंयोजक बंध होते हैं |
6. C6H14O (हेक्सेनॉल)
हेक्सेनॉल मे 19 सहसंयोजक बंध होते हैं |
7. C7H16O (हेप्टेनॉल)
हेप्टेनॉल मे 22 सहसंयोजक बंध होते हैं |
8. C8H18O (ओक्टेनोल)
ओक्टेनोल मे 25 सहसंयोजक बंध होते हैं |
कार्बोक्सिलिक अम्ल का सामान्य सूत्र
CnH2nO2
अनुलग्न – ऑइक (COOH)
Example –
1. CH2O2 (मेथेनॉइक)
मेथेनॉइक मे 5 सहसंयोजक बंध होते हैं |
2. C2H4O2 (एथेनॉइक)
एथेनॉइक मे 8 सहसंयोजक बंध होते हैं |
3. C3H6O2(प्रॉपेनॉइक)
प्रॉपेनॉइक मे 11 सहसंयोजक बंध होते हैं |
4. C4H8O2 (ब्यूटेनॉइक)
ब्यूटेनॉइक मे 14 सहसंयोजक बंध होते हैं |
5. C5H10O2 (पेंटेनॉल)
पेंटेनॉल मे 17 सहसंयोजक बंध होते हैं |
6. C6H12O2 (हेक्सेनॉइक)
हेक्सेनॉइक मे 20 सहसंयोजक बंध होते हैं |
7. C7H14O2 (हेप्टेनोइक)
हेप्टेनोइक मे 23 सहसंयोजक बंध होते हैं |
8. C8H16O2 (ओक्टेनॉइक)
ओक्टेनॉइक मे 26 सहसंयोजक बंध होते हैं |
एल्डिहाइड का सामान्य सूत्र
CnH2nO
अनुलग्न – ऐल (CHO)
Example –
1. CH2O(मैथनेल)
मैथनेल मे 4 सहसंयोजक बंध होते हैं |
2. C2H4O (एथेनेल)
एथेनेल मे 7 सहसंयोजक बंध होते हैं |
3. C3H6O (प्रोपेनेल)
प्रोपेनेल मे 10 सहसंयोजक बंध होते हैं |
4. C4H8O (ब्यूटेनेल)
ब्यूटेनेल मे 13 सहसंयोजक बंध होते हैं |
5. C5H10O (पेन्टेनेल)
पेन्टेनेल मे 16 सहसंयोजक बंध होते हैं |
6. C6H12O (हेक्सेनेल)
हेक्सेनेल मे 19 सहसंयोजक बंध होते हैं |
7. C7H14O (हेप्टेनेल)
हेप्टेनेल मे 22 सहसंयोजक बंध होते हैं |
8. C8H16O (ओक्टेनेल)
ओक्टेनेल मे 25 सहसंयोजक बंध होते हैं |
कीटोन का सामान्य सूत्र
Note – कीटोन समूह का प्रथम सदस्य प्रोपेनॉन होता है |
CnH2nO
अनुलग्न – ऑन (2R-C=O)
Example –
1. C3H6O (प्रोपेनॉन)
प्रोपेनॉन मे 10 सहसंयोजक बंध होते हैं |
2. C4H8O (ब्यूटेनॉन)
ब्यूटेनॉन मे 13 सहसंयोजक बंध होते हैं |
3. C5H10O (पेन्टेनोंन)
पेन्टेनोंन मे 16 सहसंयोजक बंध होते हैं |
4. C6H12O (हेक्सेनॉन)
हेक्सेनॉन मे 19 सहसंयोजक बंध होते हैं |
5. C7H14O (हेप्टेनॉन)
हेप्टेनॉन मे 22 सहसंयोजक बंध होते हैं |
6. C8H16O (ओक्टेनोन)
ओक्टेनोन मे 25 सहसंयोजक बंध होते हैं |
हैलोजन समूह का सामान्य सूत्र
पूर्वलग्न – क्लोरो (Cl), फ़्लोरो (F), ब्रोमो (Br), आयडो (I)
1. क्लोरो (Cl) –
1. CH3 – Cl(क्लोरोमेथेन)
क्लोरोमेथेन मे 4 सहसंयोजक बंध होते हैं |
2. C2H5 – Cl (क्लोरोएथेन)
क्लोरोएथेन मे 7 सहसंयोजक बंध होते हैं |
3. C3H7 – Cl (क्लोरोप्रोपेन)
क्लोरोप्रोपेन मे 10 सहसंयोजक बंध होते हैं |
4. C4H9 – Cl (क्लोरोब्यूटेन)
क्लोरोब्यूटेन मे 13 सहसंयोजक बंध होते हैं |
5. C5H11– Cl (क्लोरोपेंटेन)
क्लोरोपेंटेन मे 16 सहसंयोजक बंध होते हैं |
2. ब्रोमो (Br) –
1. CH3 – Br (ब्रोमोमेथेन)
ब्रोमोमेथेन मे 4 सहसंयोजक बंध होते हैं |
2. C2H5 – Br (ब्रोमोएथेन)
ब्रोमोएथेन मे 7 सहसंयोजक बंध होते हैं |
3. C3H7 – Br (क्लोरोप्रोपेन)
क्लोरोप्रोपेन मे 10 सहसंयोजक बंध होते हैं |
4. C4H9 – Br (ब्रोमोब्यूटेन)
ब्रोमोब्यूटेन मे 13 सहसंयोजक बंध होते हैं |
5. C5H11– Br (ब्रोमोपेंटेन)
ब्रोमोपेंटेन मे 16 सहसंयोजक बंध होते हैं |
3. फ़्लोरो (F) –
1. CH3 – F (फ़्लोरोमेथेन)
फ़्लोरोमेथेन मे 4 सहसंयोजक बंध होते हैं |
2. C2H5 – F (फ़्लोरोएथेन)
फ़्लोरोएथेन मे 7 सहसंयोजक बंध होते हैं |
3. C3H7 – F फ़्लोरोप्रोपेन)
फ़्लोरोप्रोपेन मे 10 सहसंयोजक बंध होते हैं |
4. C4H9 – F (फ़्लोरोब्यूटेन)
फ़्लोरोब्यूटेन मे 13 सहसंयोजक बंध होते हैं |
5. C5H11– F (फ़्लोरोपेंटेन)
फ़्लोरोपेंटेन मे 16 सहसंयोजक बंध होते हैं |
4. आयडो (I) –
1. CH3 – I (आयडोमेथेन)
आयडोमेथेन मे 4 सहसंयोजक बंध होते हैं |
2. C2H5 – I (आयडोएथेन)
आयडोएथेन मे 7 सहसंयोजक बंध होते हैं |
3. C3H7 – I (आयडोप्रोपेन)
आयडोप्रोपेन मे 10 सहसंयोजक बंध होते हैं |
4. C4H9 – I (आयडोब्यूटेन)
आयडोब्यूटेन मे 13 सहसंयोजक बंध होते हैं |
5. C5H11– I (आयडोपेंटेन)
आयडोपेंटेन मे 16 सहसंयोजक बंध होते हैं |
अपरूप (Allotropes)
Defination of Allotropes – ऐसे योगिक जो दो या दो से अधिक रूपों में पाए जाते हैं, जिनके भौतिक व रासायनिक गुणधर्म अलग–अलग होते हैं, अपरूप कहलाता है |
अपरूप दो प्रकार के होते हैं –
1. क्रिस्टलीय अपरूप (Crystalline Allotropes)
2. अक्रिस्टलीय अपरूप (Non – Crystalline Allotropes)
क्रिस्टलीय अपरूप –
Defination of Crystalline Allotropes – वे अपरूप जिनमें कार्बन परमाणु की निश्चित ज्यामिति पाई जाती है, वह क्रिस्टलीय अपरूप कहलाता है |
उदाहरण – हीरा, ग्रेफाइट, फुलेरीन
अक्रिस्टलीय अपरूप –
Defination of Non – Crystalline Allotropes – वे अपरूप जिनमें कार्बन परमाणु की निश्चित ज्यामिति नहीं पाई जाती है, वह अक्रिस्टलीय अपरूप कहलाता है |
उदाहरण – कोक, कोयला, चारकोल
हीरा (Diamond) –
- Diamond (हीरा) पारदर्शी, कठोर व चमकीला होता है |
- हीरे की संरचना चतुष्फलकीय होती है, क्योंकि हीरे की संरचना में एक कार्बन अन्य चार कारणों के साथ जुड़ा होता है |
- हीरा विद्युत का सुचालक होता है, क्योंकि हीरे की संरचना में एक कार्बन अन्य चार कार्बनो से जुड़ा होता है, जिससे हीरे की संरचना चतुष्फलकीय हो जाने के कारण इनमें कोई भी मुक्त इलेक्ट्रॉन नहीं पाया जाता है |
- इसका गलनांक 3848 K होता है |
- हीरे की संरचना में कार्बन कार्बन के मध्य दूरी 1.54A होती है |
- इसकी संरचना में प्रबल सहसंयोजक बंध पाये जाते है |
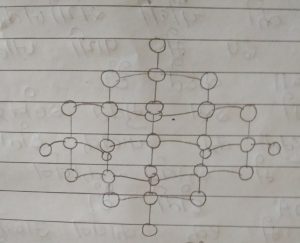
हीरे का उपयोग (Use of Diamonds) –
- इसका उपयोग रिंग बनाने में किया जाता है |
- हीरे का उपयोग कांच काटने में किया जाता है |
- हीरे का उपयोग पत्थर व चट्टाने काटने में किया जाता है |
- इसका उपयोग आभूषण बनाने में किया जाता है |
- हीरे का उपयोग संगमरमर मार्बल के पत्थर काटने में किया जाता है |
ग्रेफाइट (Graphite) –
- ग्रेफाइट शब्द ग्रेफो शब्द से मिलकर बना होता है, जिसका अर्थ होता है – लिखना |
- Graphite (ग्रेफाइट) चिकना, दूषर काले रंग का होता है |
- इसमें प्रर्दा सरचना पाई जाती है, जिसके कारण ग्रेफाइट की परतें एक दूसरे पर फिसल सकती है |
- ग्रेफाइट विद्युत का सुचालक होता है, क्योंकि ग्रेफाइट में एक कार्बन अन्य तीन कारणों से सहसंयोजक बन्ध द्वारा जुड़ा होता है |
- ग्रेफाइट में कार्बन की चौथी संयोजकता मुक्त अवस्था के रूप में पाई जाती है, जिन्हें मुक्त अवस्था कहते है |
- इस ग्रेफाइट में मुक्त इलेक्ट्रॉन के कारण विद्युत का चालक होता है |
- ग्रेफाइट में कार्बन कार्बन के मध्य दूरी 1. 42A होती है |
- ग्रेफाइट में एक कार्बन अन्य तीन कार्बनो के साथ जुड़कर सततकोणीय वलय सरचना का निर्माण करते हैं |
- इसमें सततकोणीय वलय एक दूसरे के ऊपर व्यवस्थित होते हैं |
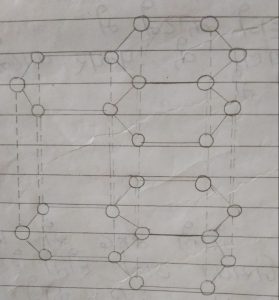
ग्रेफाइट के उपयोग (Use of Graphite) –
- इसका उपयोग लोहे की वस्तु में पॉलिश करने में किया जाता है |
- ग्रेफाइट का उपयोग पेंसिल बनाने में किया जाता है |
- इसका उपयोग नाभिकीय परमाणु भट्टी में मंदक के रूप में किया जाता है |
- ग्रेफाइट का उपयोग शुष्क स्नेहक के रूप में किया जाता है |
फुलेरीन (Fullerene) –
- फुलेरीन की संरचना गोल गुंबद जैसी होती है |
- अमेरिका के प्रसिद्ध वास्तुकार बकमिंस्टर फुलर के नाम पर इसका नाम फुलेरीन रखा गया |
- फुलेरीन के कणों में 60 से 70 कार्बन पाये जाते है |
- C – 60 स्थाई फुलेरीन है |
- C – 60 की संरचना में 32 फलक पाये जाते है |
- फुलेरीन में 20 फलक सतकोणीय तथा 12 फलक पंचकोणीय होते है |
- इसकी संरचना फुटबॉल के समान होती है, इसलिए इसे बकीबॉल कहते हैं |
- फुलेरीन विद्युत का कुचालक होता है |
- फुलरीन में कार्बन कार्बन की मध्य दूरी 1.40 A होती है |
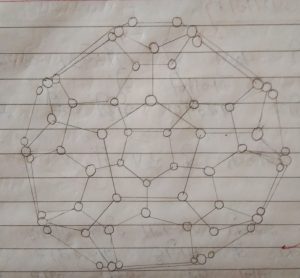
Use of Fullerene (फुलेरीन के उपयोग)
- फुलेरीन उच्च ताप पर अतिचालक होने के कारण तकनीकी दृष्टि से महत्वपूर्ण होता है |
- इसका उपयोग आणविक बेरिंग में होता है |
दहन (Combustion)
कार्बन अपने सभी रूपों में ऑक्सीजन के साथ क्रिया करके ऊष्मा एवं प्रकाश के साथ कार्बन डाइऑक्साइड गैस देता है |
C + O2 → Co2
ऑक्सीकारक (Oxidising Agent)
कुछ पदार्थों में अन्य पदार्थों को ऑक्सीजन देने की क्षमता होती है, इन पदार्थों को ऑक्सीकारक कहा जाता है |
जलते हुए पदार्थ ज्वाला उत्पन्न करते हैं क्यों ?
- एक मोमबत्ती या गैस स्टोव की एलपीजी जलते समय ज्वाला उत्पन्न करती है |
- यद्यपि आप देखेंगे कि अंगीठी में जलने वाला कोयला या तारकोल कभी–कभी लाल रंग के समान उज्जवल होता है |
- तथा बिना ज्वाला के उष्मा देता है , ऐसा इसलिए होता है क्योंकि केवल गैसीय पदार्थों के जलने पर ही ज्वाला उत्पन्न होती है |
- लकड़ी या तारकोल जलाने पर उपस्थित वाष्पशील पदार्थ व वाष्पीकृत हो जाते हैं |
- तथा आरंभ में ज्वाला के साथ जलते हैं |
- गैसीय पदार्थों के परमाणुओं को ताप देने पर एक दीप्त ज्वाला दिखाई देती है तथा उज्जवल होना प्रारंभ करती है |
- प्रत्येक तत्व के द्वारा उत्पन्न रंग उस तत्व का अभिलाक्षणिक गुण होता है |
- गैस स्टोव की ज्वाला में तांबे के तार को जलाने का प्रयास कीजिए |
- इसके रंग का परीक्षण कीजिए आपने देखा होगा कि अपूर्ण दहन से कजल उत्पन्न होता है, जो कार्बन होता है |
- इसके आधार पर आप मोमबत्ती को पीले रंग की ज्वाला का कारण बताएंगे |
संकलन अभिक्रिया
निकेल व प्लेडीयम उत्प्रेरक की उपस्थिति में तेल में हाइड्रोजन गैस प्रवाहित करने पर तेल, वनस्पति घी में रूपांतरित हो जाता है |
अर्थात असंतृप्त हाइड्रोकार्बन का संतृप्त हाइड्रोकार्बन में बदलना हाइड्रोजनीकरण या संकलन अभिक्रिया कहलाती है |
Reaction –
CR2 – CR2 + H2 → (Ni / Pd ) → CHR2 – CHR2
प्रतिस्थापन अभिक्रिया
संतृप्त हाइड्रोकार्बन अत्यधिक अनभिकृत होते है | सूर्य के प्रकाश की उपस्थिति में अति तीव्र अभिक्रिया में क्लोरीन एक–एक करके हाइड्रोजन के परमाणुओं का प्रतिस्थापन करती है, उसे प्रतिस्थापन अभिक्रिया कहते है |
सूर्य के प्रकाश की उपस्थिति में मेथेन और क्लोरीन की अभिक्रिया होने पर – क्लोरो मेथेन , हाइड्रोक्लोरिक अम्ल प्राप्त होते हैं।
Reaction –
CH4 + Cl2 → CH3Cl + HCl
एथेनॉल के गुणधर्म (Properties of Ethanol)
- एथेनॉल कमरे के ताप पर द्रव अवस्था में होता है |
- Ethanol (एथेनॉल) को एल्कोहल भी कहा जाता है |
- एथेनॉल सभी एल्कोहलो पेय पदार्थों का महत्वपूर्ण अवयव होता है |
- एथेनॉल एक अच्छा विलायक है |
- Ethanol (एथेनॉल) का उपयोग टिंचर, आयोडीन, कफ सिरप, टॉनिक आदि औषधि में किया जाता है |
- एथेनॉल को किसी भी अनुपात में जल में मिलाया जा सकता है |
- तनु एथेनॉल की थोड़ी सी मात्रा लेने पर नशा आ जाता है |
- शुद्ध एल्कोहल की मात्रा घातक सिद्ध हो सकती है |
- Ethanol (एथेनॉल) का गलनांक 156 केल्विन होता है |
- एथेनॉल का क्वथनांक 351 केल्विन होता है |
एथेनॉल की अभिक्रिया (Ethanol Reaction)
Ethanol (एथेनॉल) की सोडियम के साथ अभिक्रिया –
CH3-CH2-OH + Na → CH3-CH2-O-Na + H2
एथेनॉल की असंतृप्त हाइड्रोकार्बन बनाने की अभिक्रिया –
CH3-CH2-OH → (सान्द्र H2So4 Δ)→ CH2=CH2 + H2O
एथेनोइक अम्ल के गुणधर्म (Properties of Ethanoic Acid)
- एथेनोइक अम्ल को एसिटिक अम्ल भी कहा जाता है |
- एसिटिक अम्ल की 3- 4% विलयन को सिरका कहा जाता है |
- सिरका को आचार में परिरक्षक के रूप में इस्तेमाल किया जाता है |
- शुद्ध एथेनोइक अम्ल का गलनांक 290 केल्विन होता है |
- एथेनोइक अम्ल का क्वथनांक 391 केल्विन होता है |
- Ethanoic Acid (एथेनोइक अम्ल) शीत ऋतु के समय जम जाता है |
- एथेनोइक अम्ल को ग्लेशल एसिटिक अम्ल कहा जाता है |
एथेनोइक अम्ल की अभिक्रिया –
1. एस्टरीकरण अभिक्रिया –
एथेनोइक अम्ल किसी अम्ल उत्प्रेरक की उपस्थिति में परिशुद्ध एथेनॉल से अभिक्रिया करके एस्टर बनाते हैं |
CH3-COOH + C2H5-OH → CH3-COOC2H5 + H2O
- एस्टर की गंध मृदु होती है
- Aster (एस्टर) का उपयोग इत्र बनाने में एवं स्वाद उत्पन्न करने वाले कारक के रूप में किया जाता है |
- एस्टर पुनः एलकॉहल एवं कार्बोक्सिलिक अम्ल का सोडियम लवण बनाता है, इस अभिक्रिया को साबुनीकरण कहा जाता है |
2. एथेनोइक अम्ल की क्षारक के साथ अभिक्रिया –
एथेनॉल की भांति एथेनोइक अम्ल सोडियम हाइड्रोक्साइड जैसे क्षारक के साथ अभिक्रिया करके सोडियम एथेनाेएट या सोडियम एसीटेट तथा जल बनाता है |
CH3-COOH+ NaOH → CH3COONa + H2O
3. एथेनोइक अम्ल की कार्बोनेट तथा हाइड्रोजनकार्बोनेट के साथ अभिक्रिया –
एथेनोइक अम्ल की सोडियम कार्बोनेट के साथ अभिक्रिया –
CH3-COOH + NaCo3 → CH3COONa + Co2 + H2O
एथेनोइक अम्ल की सोडियम हाइड्रोजनकार्बोनेट के साथ अभिक्रिया –
CH3-COOH + NaHCo3 → CH3COONa + Co2 + H2O
साबुन और अपमार्जक (Soap and Detergent)
सफाई के लिए उपयुक्त होने वाले पदार्थों को साबुन और अपमार्जक कहा जाता है |
साबुन (Soap)
Soap (साबुन) 12 से 18 कार्बन परमाणु वाले उच्च वसा अम्लों जैसे स्टेऐरिक अम्ल (C17H35COOH), पोमिटिक अम्ल (C15H31COOH) अम्लों के सोडियम (Na) अथवा पोटेशियम (K) लवणों को साबुन कहते हैं |
साबुन का अणुसूत्र –
कठोर साबुन का सुत्र – C17H35COONa
मृदु साबुन का सुत्र – C17H35COOK
समीकरण –
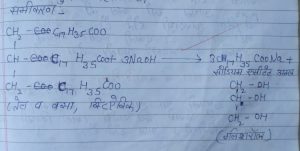
Note – वसा एवं तेल में सोडियम हाइड्रोक्साइड (NaOH) मिलाने पर ग्लिसरोल का निर्माण होता है |
अपमार्जक (Detergent)
Detergent (अपमार्जक) रासायनिक रूप से लंबी हाइड्रोकार्बन श्रंखला युक्त सल्फोनिक अम्ल (RSO3H) के सोडियम लवण होते हैं |
लंबी एल्केन श्रृंखला के सिरे पर कार्बॉक्सलिक समूह की जगह सल्फोनिक (RSO3H) समूह होते हैं |
अपमार्जक का अणुसूत्र –
C8H15C6H4(OC2H4)9OH
NOTE- साबुन की अपेक्षा अपमार्जक अधिक प्रभावशाली होते हैं, क्योंकि अपमार्जक कैलशियम, मैग्निशियम (जो जल की कठोरता के लिए उत्तरदायी होते हैं) के साथ अवक्षेप नहीं बनाते हैं | दूसरी ओर साबुन इन आयनों के साथ अवक्षेप देता है |
मिसेल निर्माण की क्रियाविधि (Mechanism of Micelle Formation)
- Micelle का निर्माण अनेक आयनो या अणुओं के सहगमन से होता है |
- इसमें द्रव स्नेही (जल विरागी) तथा जल विरोधी भाग होते हैं |
- सोडियम स्टीरेट को जल में विलय करते हैं, तो यह सोडियम तथा आयन देता है |
- RCOONa → RCOO– + Na+
- साबुन का सूत्र – C17H35COONa
- इन सोडियम स्टीरेट में लंबा मुल्क हाइड्रोकार्बन भाग जो जल विरोधी, तथा दूसरा भाग जल विरागी (द्रव स्नेही) है |
- जल विरोधी भाग – जल विरागी तथा जल स्नेही भाग – जल रागी होता है |
- जबकि हाइड्रोकार्बन की पुंछ दूसरा छोर जो जल के बाहर होती है |
- हाइड्रोकार्बन की जल के अंदर इनकी एक विशेष व्यवस्था होती है |
- जिससे इसका हाइड्रोकार्बन सीधा जल के बाहर बना होता है |
- यह हाइड्रोकार्बनो का बड़ा गुच्छ बनने के कारण होता है |
- जिसमें जल विरागी पुंछ गुच्छे के आंतरिक हिस्से में होती है | जबकि उसका आयनिक सिरा किनारे पर होता है | इस रचना को मिसेल कहते हैं |
- micelle के रूप में साबुन स्वच्छ करने में सक्षम होता है, क्योंकि अध्रुवीय भाग मिसेल के केंद्र में एकत्रित हो जाते हैं |
- मिसेल विलयन में कोलाइड के रूप में बने रहते हैं | तथा आयन अवक्षेप के कारण अवक्षेपित नहीं होते हैं |
- इस प्रकार मिसेल में तैरते मेल आसानी से हटाए जा सकते हैं |
- जब उनके मिसेल पर प्रकाश को प्रकीर्णित करते हैं | तो इस कारण साबुन का घोल बादल जैसा दिखाई देता है |
Diagram of micelle

Most Important Question
Question 1. कार्बन का परमाणु क्रमांक कितना होता है ?
Answer – 6
Question 2. कार्बन का इलेक्ट्रॉनिक विन्यास क्या होता है ?
Answer – 1s2, 2s2, 2p2
Question 3. Carbon (कार्बन) की संयोजकता कितनी होती है ?
Answer – 4
Question 4. कार्बन की संयोजकता के मध्य कितने डिग्री का कोण पाया जाता है ?
Answer – 109°28″
Question 5. वायुमंडल में कार्बन की मात्रा कितनी होती है ?
Answer – 0.03%
Question 6. कार्बन परमाणु में न्यूट्रॉन की संख्या कितनी होती है ?
Answer – 6
Question 7. भूपर्पटी में कार्बन की मात्रा कितनी होती है ?
Answer – 0.02 %
Question 8. कार्बन किसे कहते हैं ?
Answer – कार्बन एक रसायनिक तत्व है, जिसका परमाणु क्रमांक 6 होता है तथा प्रतीक “C” होता है |
Question 9. श्रंखलन की प्रवृत्ति कौन से तत्व में पाई जाती है ?
Answer – कार्बन
Question 10. कार्बन परमाणु में प्रोटोन की संख्या कितनी होती है ?
Answer – 6
Question 11. योगीक किसे कहते हैं ?
Answer – दो या दो से अधिक तत्व, पदार्थ या परमाणु मिलकर योगिक का निर्माण करते है |
Question 12. कार्बन परमाणु की द्रव्यमान संख्या कितनी होती है ?
Answer – 12
Question 13. हाइड्रोकार्बन किसे कहते हैं ?
Answer – हाइड्रोजन व कार्बन से मिलकर बने योगिक को हाइड्रोकार्बन कहते हैं |
Question 14. पूर्वलग्न का निर्धारण कैसे किया जाता है ?
Answer – कार्बन परमाणुओं की संख्या के आधार पर
Question 15. अनुलग्न का निर्धारण कैसे किया जाता है ?
Answer – कार्बन व कार्बन परमाणुओं के बीच में पाये जाने वाले बंध के आधार पर
Important Question
Question 16. कार्बन परमाणुओं के मध्य एकल बंध के लिए कौन से अनुलग्न का प्रयोग किया जाता है ?
Answer – एन
Question 17. Carbon (कार्बन) परमाणुओं के मध्य द्विबंध के लिए कौन से अनुलग्न का उपयोग किया जाता है ?
Answer – इन
Question 18. कार्बन परमाणु के मध्य त्रिबंध के लिए कौन से अनुलग्न का प्रयोग किया जाता है ?
Answer – आइन
Question 19. एल्केन श्रेणी का सामान्य सूत्र क्या होता है ?
Answer – CnH2n+2
Question 20. एल्कीन श्रेणी का सामान्य सूत्र क्या होता है ?
Answer – CnH2n
Question 21. एल्काइन श्रेणी का सामान्य सूत्र क्या होता है ?
Answer – CnH2n-2
Question 22. एल्केन श्रेणी का प्रथम सदस्य कौन सा होता है ?
Answer – मेथेन
Question 23. एल्कीन श्रेणी का प्रथम सदस्य कौन सा होता है ?
Answer – एथीन
Question 24. एल्काइन श्रेणी का प्रथम सदस्य कौन सा होता है ?
Answer – एथाइन
Question 25. एल्केन श्रेणी में कार्बन कार्बन के मध्य कौन सा बंध पाया जाता है ?
Answer – एकल बंध
Question 26 . एल्कीन श्रेणी में कार्बन कार्बन के मध्य कौन सा बंध पाया जाता है ?
Answer – द्विबंध
Question 27. एल्काइन श्रेणी में कार्बन कार्बन के मध्य कौन सा बंध पाया जाता है ?
Answer – त्रिबंध
Question 28. एल्कीन श्रेणी के सदस्यों को अन्य किस नाम से जाना जाता है ?
Answer – ओलीफंन्स
Question 29. एल्काइन श्रेणी के सदस्यों को अन्य किस नाम से जाना जाता है ?
Answer – एसिटिलीन
Question 30. एल्कोहल का सामान्य सूत्र क्या होता है ?
Answer – CnH2n+2
Chapter 4 कार्बन एंव उसके यौगिक Notes in Hindi
Question 31. एल्कोहल का अनुलग्न क्या होता है ?
Answer – ऑल (OH)
Question 32. कार्बोक्सिलिक अम्ल का सामान्य सूत्र क्या होता है ?
Answer – CnH2nO2
Question 33. कार्बोक्सिलिक अम्ल का अनुलग्न क्या होता है ?
Answer – ऑइक (COOH)
Question 34. एल्डिहाइड का सामान्य सूत्र क्या होता है ?
Answer – CnH2nO
Question 35. एल्डिहाइड का अनुलग्न क्या होता है ?
Answer – ऐल (CHO)
Question 36. कीटोन का सामान्य सूत्र क्या होता है ?
Answer – CnH2nO
Question 37. कीटोन का अनुलग्न क्या होता है ?
Answer – ऑन (2R-C=O)
Question 38. क्रिस्टलीय अपरूप किसे कहते है ?
Answer – वे अपरूप जिनमें कार्बन परमाणु की निश्चित ज्यामिति पाई जाती है, वह क्रिस्टलीय अपरूप कहलाता है |
Question 39. अक्रिस्टलीय अपरूप किसे कहते है ?
Answer – वे अपरूप जिनमें कार्बन परमाणु की निश्चित ज्यामिति नहीं पाई जाती है, वह अक्रिस्टलीय अपरूप कहलाता है |
Question 40. क्रिस्टलीय अपरूप के उदाहरण दीजिए ?
Answer – हीरा, ग्रेफाइट, फुलेरीन
Important Question
Question 41. अक्रिस्टलीय अपरूप के उदाहरण दीजिए ?
Answer – कोक, कोयला, चारकोल
Question 42. हीरे का गलनांक 3848 K कितना होता है ?
Answer – 3848 K
Question 43. ग्रेफाइट में कार्बन कार्बन के मध्य दूरी कितनी होती है ?
Answer – मध्य दूरी 1. 42A
Question 44. हीरे में कार्बन कार्बन के मध्य दूरी कितनी होती है ?
Answer – मध्य दूरी 1.54A
Question 45. फुलेरीन में कार्बन कार्बन के मध्य दूरी कितनी होती है ?
Answer – मध्य दूरी 1.40A
Question 46. बकीबॉल किसे कहते है ?
Answer – फुलेरीन की संरचना फुटबॉल के समान होती है, इसलिए इसे बकीबॉल कहते हैं |
Question 47. फुलेरीन की संरचना कैसी होती है ?
Answer – गोल गुंबद जैसी
Question 48. संकलन अभिक्रिया किसे कहते है ?
Answer – निकेल व प्लेडीयम उत्प्रेरक की उपस्थिति में तेल में हाइड्रोजन गैस प्रवाहित करने पर तेल, वनस्पति घी में रूपांतरित हो जाता है |
अर्थात असंतृप्त हाइड्रोकार्बन का संतृप्त हाइड्रोकार्बन में बदलना हाइड्रोजनीकरण या संकलन अभिक्रिया कहलाती है |
Question 49. प्रतिस्थापन अभिक्रिया किसे कहते है ?
Answer – संतृप्त हाइड्रोकार्बन अत्यधिक अनभिकृत होते है | सूर्य के प्रकाश की उपस्थिति में अति तीव्र अभिक्रिया में क्लोरीन एक–एक करके हाइड्रोजन के परमाणुओं का प्रतिस्थापन करती है, उसे प्रतिस्थापन अभिक्रिया कहते है |
Question 50. ऑक्सीकारक किसे कहते है ?
Answer – कुछ पदार्थों में अन्य पदार्थों को ऑक्सीजन देने की क्षमता होती है, इन पदार्थों को ऑक्सीकारक कहा जाता है |
Important Question
Question 51. दहन किसे कहते है ?
Answer – कार्बन अपने सभी रूपों में ऑक्सीजन के साथ क्रिया करके ऊष्मा एवं प्रकाश के साथ कार्बन डाइऑक्साइड गैस देता है | कार्बन का दहन कहलाता है |
Question 52. तेल में कौनसी गैस को प्रवाहित करने पर तेल, वनस्पति घी में रूपांतरित हो जाता है ?
Answer – हाइड्रोजन गैस
Question 53. एथेनॉल का गलनांक कितना होता है ?
Answer – 156 केल्विन
Question 54. एथेनॉल का क्वथनांक कितना होता है ?
Answer – 351 केल्विन
Question 55. शुद्ध एथेनोइक अम्ल का गलनांक कितना होता है ?
Answer – 290 केल्विन
Question 56. एथेनोइक अम्ल का क्वथनांक कितना होता है ?
Answer – 391 केल्विन
Question 57. एथेनोइक अम्ल को अन्य किस नाम से जाना जाता है ?
Answer – ग्लेशल एसिटिक अम्ल
Question 58. साबुनीकरण किसे कहते है ?
Answer – एस्टर पुनः एलकॉहल एवं कार्बोक्सिलिक अम्ल का सोडियम लवण बनाता है, इस अभिक्रिया को साबुनीकरण कहा जाता है |
Question 59. आचार में परिरक्षक के रूप में किसका इस्तेमाल किया जाता है ?
Answer – सिरका
Question 60. एथेनॉल का उपयोग किसमें किया जाता है ?
Answer – टिंचर, आयोडीन, कफ सिरप, टॉनिक आदि औषधि में
Important Question
Question 61. साबुन किसे कहते है ?
Answer – साबुन 12 से 18 कार्बन परमाणु वाले उच्च वसा अम्लों जैसे स्टेऐरिक अम्ल (C17H35COOH), पोमिटिक अम्ल (C15H31COOH) अम्लों के सोडियम (Na) अथवा पोटेशियम (K) लवणों को साबुन कहते हैं |
Question 62. अपमार्जक किसे कहते है ?
Answer – अपमार्जक रासायनिक रूप से लंबी हाइड्रोकार्बन श्रंखला युक्त सल्फोनिक अम्ल (RSO3H) के सोडियम लवण होते हैं |
Question 63. कठोर साबुन का सुत्र क्या होता है ?
Answer – C17H35COONa
Question 64. मृदु साबुन का सुत्र क्या होता है ?
Answer – C17H35COOK
Question 65. अपमार्जक का सुत्र क्या होता है ?
Answer – C8H15C6H4(OC2H4)9OH
Question 66. ग्लिसरोल किसे कहते है ?
Answer – वसा एवं तेल में सोडियम हाइड्रोक्साइड (NaOH) मिलाने पर ग्लिसरोल का निर्माण होता है |
उपरोक्त पोस्ट में 10th Science Chapter 4 कार्बन एंव उसके यौगिक Notes in Hindi के बारे में विस्तृत जानकारी दी हुई है | इसके अतिरिक्त अगर आप विज्ञान के और भी अध्यायों का अध्यन करना चाहे तो आप हमारी वेबसाइट पर कर सकते है | कुछ महत्वपूर्ण लिंक निचे दिए है |
Other Topic Important Links
Science More Important Topics you can click here
Hindi More Important Topics you can read here
Rajasthan GK More Important Topics click here
Psychology More Important Topics you can read here
today in this post we share Chapter 4 कार्बन एंव उसके यौगिक Notes in Hindi for class 10th , science notes in Chapter 4 कार्बन एंव उसके यौगिक Notes in Hindi, you are read here Chapter 4 कार्बन एंव उसके यौगिक Notes in Hindi , class 10th Chapter 4 कार्बन एंव उसके यौगिक Notes in Hindi.

