नमस्कार दोस्तों ! आज की इस पोस्ट में हम आपके लिए लेकर आये है विज्ञान का महत्वपूर्ण Chapter 3 धातु और अधातु Notes in Hindi.
इस पोस्ट में विज्ञान के महत्वपूर्ण Chapter 3 धातु और अधातु Notes in Hindi Class 10thके बारे में जानकारी दी गयी है | धातु, धातुओं के भौतिक गुणधर्म, अवस्था ,कठोरता, आघातवर्धनीयता व तन्यता , अधातु, अधातुओं के भौतिक गुणधर्म, अवस्था ,कठोरता, धातुओं के रासायनिक गुणधर्म, उभयधर्मी ऑक्साइड ,धातुओं के साथ ऑक्सीजन की अभिक्रिया,धातुओं की जल के साथ अभिक्रिया, धातुओं की अम्लों के साथ अभिक्रिया व एनोडीकरण , ऑक्सीकरण संख्या, आयनिक यौगिकों का निर्माण व आयनिक यौगिकों के गुण , खनिज ,अयस्क, गैंग व सक्रियता श्रेणी, विद्युत अपघटनी परिष्करण व संक्षारण आदि कक्षा 10 वी की परीक्षा में आने वाले महत्वपूर्ण टॉपिक है | यह topics कक्षा 10 वी साइंस का Chapter – 3 “धातु और अधातु” से लिया गया है |
धातु (Metals)
Defination of Metal – वे तत्व या परमाणु जो इलेक्ट्रॉन त्याग कर धनायन बनाते हैं धातु कहलाते हैं |
Example – आयरन (Fe), कॉपर (Cu), जिंक (Zn), एल्युमीनियम Al), सोडियम (Na), पोटेशियम (K), लिथियम (Li), मैग्नीशियम (Mg)
धातुओं के भौतिक गुणधर्म (Physical Properties of Metals)
1. अवस्था – सामान्य धातुएं ठोस होती है |
Note – अपवाद – मर्करी / पारा /Hg धातु द्रव अवस्था के अंदर होती है |
2. कठोरता – अधिकतर धातुएं कठोर होती है |
Example – लिथियम (Li), सोडियम (Na), पोटेशियम (K) धातुएं नरम तथा मुलायम होती है , जिनको चाकू की सहायता से काटा जा सकता है |
3. आघातवर्धनीयता – धातु का ऐसा गुण जिसमें धातु को पीटकर पतली चादर बनाना या सीट में बदलना आघातवर्धनीयता कहलाता है |
Example – एल्युमीनियम (Al), सिल्वर (Ag), आयरन (Fe), कॉपर (Cu)
Note – चांदी / सिल्वर (Ag) सबसे ज्यादा आघातवर्धनीय धातु है |
4. तन्यता – धातुओं का वह गुण जिन्हे खींचकर तारों के रूप में परिवर्तित करना या लंबाई में वृद्धि करना तन्यता कहलाता है |
Note- सबसे अधिक तन्य धातु सोना / ओरम / Au होती है | 1 ग्राम सोने से 2 किलोमीटर तक वृद्धि कर सकते हैं |
5. उष्मा व विद्युत की सुचालक धातु – वे पदार्थ जिनमें विद्युत धारा या उष्मा का प्रवाह आसानी से होता है उसे विद्युत का सुचालक कहते हैं |
Note – सबसे अधिक विद्युत के सुचालक धातु सिल्वर (Ag) व कॉपर (Cu) होता है |
अपवाद –
उष्मा व विद्युत का कुचालक – वे पदार्थ या धातु जिनमें उष्मा का प्रवाह आसानी से नहीं होता है उन्हें विद्युत का कुचालक कहते हैं |
Example – पारा ( मरकरी / Hg), लेड (सीसा / Pb)
6. ध्वानिक (सोनोरस) – वे धातु जो कठोर सतह से टकराने पर ध्वनि उत्पन्न करती है उन्हें ध्वानिक (सोनोरस) कहते हैं |
अधातु (Non Metal)
Defination of Non Metal – वे तत्व या परमाणु जो इलेक्ट्रॉन ग्रहण करके ऋणयन बनाते हैं अधातु कहलाते हैं |
अथवा
धातुओं के विपरीत गुण रखने वाले पदार्थ या परमाणु अधातु कहलाते हैं |
Example – हीलियम (He), नियॉन (Ne), आर्गन (Ar), क्रिप्टोन (Kr), जिनोन (Xe), रेडोन (Rn), फ्लोरीन (F), क्लोरीन (Cl), आयोडीन (I), ऑक्सीजन (O), नाइट्रोजन (N), फास्फोरस (P), सल्फर (S) इत्यादि
अधातुओं के भौतिक गुणधर्म (Physical Properties of Non Metals)
अपवाद
1. कठोर अधातु – हीरा (कार्बन का क्रिस्टलीय अपरूप)
2. सुचालक अधातु – ग्रेफाइट (कार्बन का क्रिस्टलीय अपरूप)
3. चमकीला अधातु – आयोडाइड (I)
4. क्रियाशील अधातु – फास्फोरस (P) , इसे जल के अंदर रखा जाता है |
5. द्रव अधातु – ब्रोमीन (Br)
6. गैसीय अधातु – नाइट्रोजन (N), ऑक्सीजन (O), हीलियम (He), नियॉन (Ne), आर्गन (Ar), क्रिप्टोन (Kr), जिनोन (Xe), रेडोन (Rn)
7. ठोस अवस्था में पाई जाने वाली अधातुए – आयोडाइड (I), फास्फोरस (P)
धातुओं का दहन (Combustion of Metals)
धातु + ऑक्सीजन → धातु ऑक्साइड
4Na + O2 → 2Na2O
4K + O2 → 2K2O
2Zn + O2 → 2ZnO
2Mg + O2 → 2MgO
धातु ऑक्साइड + जल → धातु हाइड्रोक्साइड
Na2O + H2O → 2NaOH
K2O + H2O → 2KOH
Note – वे धातु हाइड्रोक्साइड जो जल में घुलनशील होते हैं उन्हें क्षार कहते हैं |
उदाहरण – सोडियम हाइड्रोक्साइड (NaOH), पोटेशियम हाइड्रोक्साइड (KOH), कैलशियम हाइड्रोक्साइड {Ca(OH)2 }
उभयधर्मी ऑक्साइड (Aphoteric Oxide)
वे धातु ऑक्साइड जो अम्ल व क्षारक के के साथ अभिक्रिया करके लवण + जल प्रदान करते है उन धातु ऑक्साइडों को उभयधर्मी ऑक्साइड कहते है |
Example –
एल्यूमीनियम ऑक्साइड (Al2O3)
जिंक ऑक्साइड (ZnO)
Al2O3 + 6HCl → 2AlCl3 + 3H2o
Al2O3 + 2NaOH → 2NaAlo2 + H2o
अतः धातु ऑक्साइड क्षारीय प्रकृति के होते हैं |
धातुओं के साथ ऑक्सीजन की अभिक्रिया
- पोटेशियम तथा सोडियम जेसी धातुएं इतनी तेजी से अभिक्रिया करती है | कि खुले रखने पर आग पकड़ लेती है | इसलिए इन्हें सुरक्षित रखने तथा आकस्मिक आग को रोकने के लिए केरोसिन के तेल में डुबोकर रखा जाता है |
- सामान्य ताप पर मैग्नीशियम, एल्युमीनियम, जिंक, लैड आदि जैसी धातुओं की सतह पर ऑक्साइड की पतली परत चढ़ जाती है | ऑक्साइड की यह परत धातु को पुनः ऑक्सीकरण से सुरक्षित रखती है | गर्म करने पर आयरन का दहन तो नहीं होता है लेकिन जब बर्नर की ज्वाला में लोहे चूर्ण डालते हैं तो वह तेजी से जलने लगता है , कॉपर का दहन तो नहीं होता लेकिन गरम धातु पर कॉपर ऑक्साइड की काले रंग की परत चढ़ जाती है |
- सिल्वर एंड गोल्ड अत्यंत अधिक ताप पर भी ऑक्सीजन के साथ अभिक्रिया नहीं करते हैं |
एनोडीकरण (Anodization)
- एनोडीकरण एल्युमीनियम पर मोटी ऑक्साइड की परत बनाने की प्रक्रिया है |
- वायु के संपर्क में आने पर एल्युमीनियम पर ऑक्साइड की पतली परत का निर्माण होता है |
- एल्युमीनियम ऑक्साइड की परत इसे संक्षारण से बचाती है | इस परत को मोटा करके इसे संक्षारण से अधिक सुरक्षित किया जा सकता है |
- एनोडीकरण के लिए एल्युमीनियम की एक वस्तु को एनोड बनाकर तनु सल्फ्यूरिक अम्ल के साथ इस का विद्युत अपघटन किया जाता है |
- एनोड पर उत्सर्जित ऑक्सीजन गैस एलुमिनियम के साथ अभिक्रिया करके ऑक्साइड की मोटी परत बनाती है |
- इस ऑक्साइड की परत को आसानी से रंग कर एलुमिनियम की आकर्षण वस्तुएं बनाई जा सकती है |
- एलुमिनियम पर मोटी ऑक्साइड की परत एलुमिनियम को संक्षारित होने से या जंग लगने से बचाती है उसे एनोडीकरण कहते हैं |
धातुओं की जल के साथ अभिक्रिया
धातु + जल → धातु ऑक्साइड
धातु ऑक्साइड + जल → धातु हाइड्रोक्साइड
धातुओं की ठंडे जल के साथ अभिक्रिया –
Reaction –
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
- जब सोडियम और पोटेशियम को जल के अंदर डाला जाता है तो यह जल से अभिक्रिया करके क्षारक व हाइड्रोजन गैस का निर्माण करती हैं | साथ में इस अभिक्रिया में ऊर्जा निकलती है |
- इस कारण इस अभिक्रिया में उत्पन्न होने वाली हाइड्रोजन गैस प्रज्वलित होते हुए दिखाई देती है | इसलिए इस अभिक्रिया में यह महसूस होता है कि सोडियम और पोटेशियम जल के साथ अभिक्रिया करके आग पकड़ लेती है |
धातुओं की गर्म जल के साथ अभिक्रिया –
Reaction –
Ca + 2H2O → Ca(OH)2 + H2
Mg + 2H2O → Mg(OH)2 + H2
- कैल्शियम व मैग्नीशियम शीतल जल के साथ अभिक्रिया नहीं करता है , परंतु गर्म जल के साथ अभिक्रिया करके कैल्शियम हाइड्रोक्साइड व मैग्निशियम हाइड्रोक्साइड + H2 गैस उत्पन्न करता है |
- इन सभी अभिक्रियाओं में उत्पन्न हाइड्रोजन गैस (जल के बुलबुले) इन धातुओं के साथ चिपक कर जल की सतह पर तैरने में सहयोग करते हैं |
धातुओं की भाप के साथ अभिक्रिया –
Reaction –
2Al + 3H2O → Al2O3 + 3H2
3Fe + 4H2O → Fe3O4 + 4H2
Zn + H2O → ZnO + H2
- एल्युमीनियम (Al), जिंक (Zn), आयरन (Fe) जैसी धातुएं न तो ठंडे जल और ना ही गर्म जल के साथ अभिक्रिया करती है , परंतु भाप के साथ अभिक्रिया करके धातु ऑक्साइड व हाइड्रोजन गैस उत्पन्न करती हैं |
- कॉपर (Cu), सिल्वर (Ag), लैड (Pb), ओरम (Au) जेसी धातुएं किसी भी प्रकार के जल के साथ अभिक्रिया नहीं करती है | ये मुक्त अवस्था में पाई जाती है |
धातुओं की अम्लों के साथ अभिक्रिया
धातु + अम्ल → लवण + H2
Mg + H2So4 → MgSo4 + H2
Ca + H2So4 → CaSo4 + H2
4Al+ HCl → 2Al2Cl3 + 3H2
Fe + H2So4 → FeSo4 + H2
Zn + H2So4 → ZnSo4 + H2
बुलबुले बनने की दर के आधार पर धातुओं की क्रियाशीलता का क्रम –
कैल्शियम > मैग्नीशियम > आयरन > जिंक
Ca > Mg > Fe > Zn
एक्वारेजिया (अम्लराज)
तीन भाग हाइड्रोक्लोरिक अम्ल (HCl) और एक भाग नाइट्रिक अम्ल (HNO3) मिलकर एक्वारेजिया का निर्माण करते हैं | उदाहरण – सोने (Au) को ग्लाने में |
ऑक्सीकरण संख्या (Oxidation Number)
Defination of oxidation number – किसी योगिक या अणु में किसी परमाणु पर उपस्थित आवेश की मात्रा को ऑक्सीकरण संख्या कहते हैं |
क्षार धातुओं की ऑक्सीकरण संख्या –
H, Li, Na, K, Rb, Cs, Fr – +1
क्षार मृदा धातुओं की ऑक्सीकरण संख्या –
Be, Mg, Ca, Sr, Ba, Ru – +2
हैलोजन की ऑक्सीकरण संख्या –
F, Cl, Br, I, At – -1
आयनिक यौगिकों का निर्माण
योगिक NaCl का निर्माण –
Na Cl
+1 -1
NaCl
- NaCl के निर्माण में Na परमाणु एक इलेक्ट्रॉन त्याग कर Na+ का निर्माण करता है |
- त्यागा गया परमाणु Cl ग्रहण करके Cl – बनाता है |
- Na+ व Cl – आयन मिलकर NaCl का निर्माण करता है |
योगिक MgCl2 का निर्माण –
Mg Cl
+2 -1
MgCl2
- MgCl2 के निर्माण में Mg परमाणु दो इलेक्ट्रॉन त्याग कर Mg+ का निर्माण करता है |
- त्यागे गए दो परमाणु Cl ग्रहण करके 2Cl- बनाता है |
- Mg+2व 2Cl- आयन मिलकर MgCl2 का निर्माण करता है |
योगिक AlCl3 का निर्माण –
Al Cl
+3 -1
AlCl3
- AlCl3 के निर्माण में Al परमाणु तीन इलेक्ट्रॉन त्याग कर Al+3 का निर्माण करता है |
- त्यागे गए तीन इलेक्ट्रॉन Cl ग्रहण करके 3Cl- बनाता है |
- Al+3 व 3Cl- आयन मिलकर AlCl3 का निर्माण करते हैं |
योगिक Al(OH)3 का निर्माण –
Al OH
+3 -1
Al(OH)3
- Al(OH)3 के निर्माण में Al परमाणु तीन इलेक्ट्रॉन त्याग कर Al+3 का निर्माण करता है |
- त्यागे गए तीन इलेक्ट्रॉन OH ग्रहण करके 3OH- बनाता है |
- Al+3 व 3OH- आयन मिलकर Al(OH)3 का निर्माण करते हैं |
योगिक KOH का निर्माण –
K OH
+1 -1
KOH
- KOH के निर्माण में K परमाणु एक इलेक्ट्रॉन त्याग कर K+ का निर्माण करता है |
- त्यागे गए इलेक्ट्रॉन को OH ग्रहण करके OH- बनाता है |
- K+ व OH- आयन मिलकर KOH का निर्माण करते हैं |
आयनिक यौगिकों के गुण
1. भौतिक प्रकृति –
- धन एवं ऋण आयनो के बीच मजबूत आकर्षण बल के कारण आयनिक यौगिक ठोस एवं थोड़े कठोर होते हैं |
- यह योगिक सामान्यतः भंगुर प्रकृति के होते हैं |
- तथा दाब डालने पर टुकड़ों में टूट जाते हैं |
2. गलनांक एवं क्वथनांक –
- आयनिक यौगिकों का गलनांक एवं क्वथनांक बहुत अधिक होता है |
- क्योंकि मजबूत अंतर आयनिक आकर्षण को तोड़ने के लिए ऊर्जा की पर्याप्त मात्रा में आवश्यकता होती है |
3. घुलनशीलता –
- वैधुत संयोजक योगिक सामान्यतः जल में घुलनशील होते है |
- तथा केरोसिन, पेट्रोल आदि जैसे विलायकों में अविलेय होते है |
4. विद्युत चालकता –
- किसी विलयन से विद्युत के चालन के लिए आवेशित कणों की गतिशीलता आवश्यक होती है |
- आयनिक यौगिकों के जलीय विलयन में आयन उपस्थित होते हैं |
- जब विलयन में विद्युत धारा प्रवाहित की जाती है तो यह आयन विपरीत इलेक्ट्रोड की ओर गमन करने लगते है |
- ठोस अवस्था में आयनिक यौगिक विद्युत का चालन नहीं करते हैं |
- क्योंकि ठोस अवस्था दृढ संरचना के कारण आयनो की गति संभव नहीं होती है |
- लेकिन आयनिक यौगिक गलित अवस्था में विद्युत का चालन करते है |
- क्योंकि गलित अवस्था में विपरीत आवेश वाले आयनो के मध्य स्थिर वैद्युत आकर्षण बल उष्मा के कारण कमजोर पड़ जाता है |
- इसलिए आयन स्वतंत्र रूप से गमन करते हैं एवं विद्युत का चालन करते हैं |
धातुओं का निष्कर्षण
K
Na
Ca विद्युत अपघटन
Mg
Al
Zn
Fe कार्बन के उपयोग से अपचयन
Pb
Cu
Ag प्राकृतिक अवस्था में उपस्थिति
Au
खनिज (Minerals)
Defination of minerals – पृथ्वी की भूपर्पटी में प्राकृतिक रूप से पाए जाने वाले तत्व या यौगिक को खनिज कहते हैं |
अयस्क (Ore)
Defination of ore – वे खनिज जिनको कम लागत व आसानी से प्राप्त किया जा सकता है, इन खनिजों को अयस्क कहते हैं |
गैंग (Gang)
Defination of gang – पृथ्वी से खनित अयस्कों में मिट्टी, रेत आदि जैसी कई अशुदियां होती है, जिन्हें गैंग करते हैं |
अयस्क से धातु निष्कर्षण में प्रयुक्त चरण

सक्रियता श्रेणी (Activity Grade)
Defination of activity grade – धातुओं की क्रियाशीलता के आधार पर अवरोही क्रम में व्यवस्थित करने पर जो सूची प्राप्त होती है, उसे सक्रियता श्रेणी कहते हैं |
क्रियाशीलता का घटता क्रम –
Trick – पो सो के मे ए जी आ ले का म सी गो
पो K
सो Na
के Ca
मे Mg
ए Al
जी Zn
आ Fe
ले Pb
का Cu
म Hg
सी Ag
गो Au
सक्रियता श्रेणी से नीचे आने वाली धातुओं का निष्कर्षण –
- सक्रियता श्रेणी से नीचे आने वाली धातुएं काफी अनभिक्रिय होती है |
- इन धातुओं के ऑक्साइड को केवल गर्म करने से ही धातु प्राप्त किया जा सकता है |
- उदाहरण के लिए सीनाबार (HgS) , मर्करी का एक अयस्क है |
- वायु में गर्म करने पर यह सबसे पहले मरक्यूरिक ऑक्साइड (HgO) में परिवर्तित होता है |
- और अधिक गर्म करने पर मरक्यूरिक ऑक्साइड मर्करी में अपचयित हो जाता है |
2HgS + 3O2 → 2HgO + 2So2
2HgO → 2Hg + O2
- प्राकृतिक रूप से Cu2S के रूप में उपलब्ध तांबे को केवल वायु में गर्म करके इसको अयस्क से अलग किया जा सकता है |
2 Cu2S + 3O2 → 2 Cu2O + 2So2
2 Cu2O + Cu2S→ 6Cu+ So2
सक्रियता श्रेणी के मध्य में स्थित धातुओ का निष्कर्षण –
- सक्रियता श्रेणी में मध्य में स्थित धातुए जैसे – आयरन, जिंक , लेड, कोपर आदि की अभिक्रियाशीलता मध्यम होती है |
- प्रकृति में यह प्राय सल्फाइड या कार्बोनेट के रूप में पाई जाती है |
1. भर्जन – सल्फाइड अयस्क को वायु की उपस्थिति में अधिक ताप पर गर्म करने पर यह ऑक्साइड में परिवर्तित हो जाता है, इस प्रक्रिया को भर्जन कहते हैं |
Reaction –
2ZnS + 3O2 → 2ZnO + 2So2
2. निस्तापन – कार्बोनेट अयस्क को सीमित वायु में अधिक ताप पर गर्म करने से यह ऑक्साइड में परिवर्तित हो जाता है, इस प्रक्रिया को निस्तापन कहा जाता है |
Reaction –
ZnCo3 → ZnO + Co2
- कार्बन जैसे उपयुक्त अपचायक का उपयोग कर धातु ऑक्साइड से धातु प्राप्त किया जाता है |
- उदाहरण के लिए जब जिंक ऑक्साइड को कार्बन के साथ गर्म किया जाता है तो यह जिंक धातु में उपचयित हो जाता है |
Reaction –
ZnO + C → Zn + CO
- कार्बन (कोयला) का उपयोग कर धातु के ऑक्साइड को धातु में अपचयन करने के अलावा विस्थापन अभिक्रिया का भी उपयोग किया जाता है |
- अत्यधिक अभिक्रियाशील धातुए सोडियम, कैल्शियम, एल्युमीनियम आदि को उपचायक के रूप में उपयोग किया जा सकता है |
- क्योंकि यह निम्न अभिक्रियाशीलता वाले धातुओं को उनके योगीकौ से विस्थापित कर सकते हैं |
- उदाहरण के लिए जब मैंगनीज डाइऑक्साइड को एल्युमीनियम चूर्ण के साथ गर्म किया जाता है तो निम्न अभिक्रिया होती है –
3MnO2 + 4Al → 3Mn + 2Al2O3 + Energy
3. थर्मिट अभिक्रिया – वह रसायनिक अभिक्रिया जिसमें आयरन ऑक्साइड के साथ एलुमिनियम की अभिक्रिया का उपयोग रेल की पटरी एवं मशीनी पुर्जो की दरारों को जोड़ने के लिए किया जाता है, इस अभिक्रिया को थर्मिट अभिक्रिया कहते हैं |
Reaction –
Fe2O3 + 2Al → 2Fe + Al2O3 + Energy
सक्रियता श्रेणी में सबसे उपस्थित धातुओं का निष्कर्षण –
- अभिक्रियाशीलता श्रेणी में सबसे ऊपर स्थित धातुए अत्यंत अभिक्रियाशील होती है |
- इन्हें कार्बन के साथ गर्म करने पर इनके योगीको को प्राप्त नहीं किया जा सकता है |
- इन धातुओं को विद्युत अपघटनी उपचयन द्वारा प्राप्त किया जाता है |
- उदाहरण के लिए सोडियम, मैग्निशियम एवं कैल्शियम को उनके गलित क्लोराइडओं के विद्युत अपघटन से प्राप्त किया जाता है |
- कैथोड पर धातुए निक्षेपित होती है |
- तथा एनोड पर (धन आवेशित इलेक्ट्रोड) पर क्लोरीन मुक्त होती है |
- अभिक्रिया निम्न प्रकार है –
At Cathode –
Na+ + e- → Na
At Anode –
2Cl- → Cl2 + 2e-

विद्युत अपघटनी परिष्करण
- कॉपर, जिंक, टिन, निकिल, सिल्वर, गोल्ड आदि जैसी अनेक धातुओं का परिष्करण विद्युत अपघटन द्वारा किया जाता है |
- इस प्रकम में अशुद्ध धातू को एनोड तथा शुद्ध धातु की पतली परत को कैथोड बनाया जाता है | धातु के विलयन का उपयोग विद्युत अपघट्य के रूप में होता है |
- विद्युत अपघट्य में जब विद्युत धारा प्रवाहित की जाती है तब एनोड पर स्थित अशुद्ध धातु विद्युत अपघट्य में घुल जाती है |
- इतनी ही मात्रा में शुद्ध धातु विद्युत अपघट्य से कैथोड पर निक्षेपित हो जाती है |
- विलेय अशुद्धियां विलयन में चली जाती है |
- तथा अविलेय अशुद्धियां निक्षेपित हो जाती है , जिन्हें एनोड पंक कहते हैं |
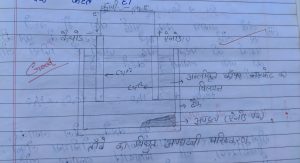
संक्षारण (Corrosion)
1. खुली वायु में कुछ दिन छोड़ देने पर सिल्वर की वस्तुएं काली हो जाती है | सिल्वर का वायु में उपस्थित सल्फर के साथ अभिक्रिया कर सिल्वर सल्फाइड की परत बनने के कारण ऐसा होता है |
Reaction –
2Ag + H2S → Ag2S + H2
2. कॉपर वायु में उपस्थित आद्र कार्बन डाइऑक्साइड के साथ अभिक्रिया करता है , जिससे इसकी सतह से भूरे रंग की चमक धीरे–धीरे खत्म हो जाती है | तथा इस पर हरे रंग की परत चढ जाती है | यह हरा पदार्थ कॉपर कार्बोनेट होता है |
Reaction –
Cu + Co2 + 1/2H2O → CuCo3
3. लंबे समय तक आद्र वायु में रहने पर लोहे पर भूरे रंग की परत चढ जाती है | जिसे लोहे पर जंग लगना कहते हैं |
Reaction –
Fe2o3 + xH2O → Fe2o3.xH2O
संक्षारण से सुरक्षा
- पेंट करके
- तेल लगाकर
- ग्रीस लगाकर
- यशदलेपन
- क्रोमियम लेपन
- एनोडीकरण
- मिश्र धातु बनाकर लोहे को जंग लगने से बचाया जा सकता है |
1. यशदलेपन –
लोहे एवं इस्पात को जंग से सुरक्षित रखने के लिए उन पर जिंक की पतली परत चढ़ाने की विधि को यशदलेपन कहते हैं |
2. मिश्र धातु –
दो या दो से अधिक धातुओं के समांगी मिश्रण को मिश्र धातु कहते है |
3. अमलगम –
यदि कोई धातु पारद है तो इसके मिश्र धातु को अमलगम कहते हैं |
Note – शुद्ध धातु की अपेक्षा उसके मिश्र धातु की विद्युत चालकता तथा गलनांक कम होता है |
उदाहरण के लिए –
- तांबा एवं जस्ता (Cu व Zn) की मिश्र धातु – पीतल
- तथा तांबा एवं टिन (Cu व Sn) की मिश्र धातु – काँसा विद्युत का कुचालक है |
- लेकिन तांबे का उपयोग विद्युतीय परिपथ बनाने में किया जाता है |
- शीशा एवं टिन (Pb व Sn) के मिश्र धातु – शोल्डर है |
Very Important Question
Question 1. तांबे एंव जस्ते से कोनसी मिश्र धातु का निर्माण होता है ?
Answer – पीतल
Question 2. तांबे एंव टिन से कोनसी मिश्र धातु का निर्माण होता है ?
Answer – काँसा
Question 3. विद्युतीय परिपथ बनाने में कोनसी धातु का उपयोग किया जाता है ?
Answer – तांबा
Question 4. मिश्र धातु किसे कहते हैं ?
Answer – दो या दो से अधिक धातुओं के समांगी मिश्रण को मिश्र धातु कहते है |
Question 5. अमलगम किसे कहते हैं ?
Answer – यदि कोई धातु पारद है तो इसके मिश्र धातु को अमलगम कहते हैं |
Question 6. यशदलेपन किसे कहते हैं ?
Answer – लोहे एवं इस्पात को जंग से सुरक्षित रखने के लिए उन पर जिंक की पतली परत चढ़ाने की विधि को यशदलेपन कहते हैं |
Question 7. लोहे पर जंग लगने से लोहे का रंग कैसा हो जाता है ?
Answer – भूरा
Question 8. संक्षारण किसे कहते हैं ?
Answer – जब कोई धातु अपने आस पास अम्ल आद्रता आदि के संपर्क में आती है तब यह संक्षारित हो जाती है इस प्रक्रिया को संक्षारण कहते है |
Question 9. चांदी पर जंग लगने से चांदी का रंग कैसा हो जाता है ?
Answer – काला
Question 10. संक्षारित होने के कारण तांबे का रंग कैसा हो जाता है ?
Answer – हरा
Important Question
Question 11. धातु किसे कहते हैं ?
Answer – वे तत्व या परमाणु जो इलेक्ट्रॉन त्याग कर धनायन बनाते हैं धातु कहलाते हैं |
Question 12. सबसे अधिक तन्य धातु कौन सी होती है ?
Answer – सोना / ओरम / Au
Question 13. कौन सी धातु में सबसे अधिक आघातवर्धनीयता होती है ?
Answer – चांदी / सिल्वर (Ag)
Question 14. कौन सी धातु को खींच कर लंबे तार के रूप में परिवर्तित किया जा सकता है ?
Answer – सोना / ओरम / Au
Question 15. सोनोरस किसे कहते हैं ?
Answer – वे धातु जो कठोर सतह से टकराने पर ध्वनि उत्पन्न करती है उन्हें ध्वानिक (सोनोरस) कहते हैं |
Question 16. कौन सी धातुओं को चाकू की सहायता से काटा जा सकता है ?
Answer – लिथियम (Li), सोडियम (Na), पोटेशियम (K)
Question 17. कौनसी धातु द्रव अवस्था में पाई जाती है ?
Answer – पारा ( मरकरी / Hg)
Question 18. अधातु किसे कहते हैं ?
Answer – वे तत्व या परमाणु जो इलेक्ट्रॉन ग्रहण करके ऋणयन बनाते हैं अधातु कहलाते हैं |
Question 19. कौन सी अधातु ठोस अवस्था में पाई जाती है ?
Answer – आयोडाइड (I), फास्फोरस (P)
Question 20. कौन सी अधातु द्रव अवस्था में पाई जाती है ?
Answer – ब्रोमीन (Br)
Important Question
Question 21. क्रियाशील अधातु कौन सी होती है ?
Answer – फास्फोरस (P)
Question 22. जल के अंदर कौन सी अधातु को रखा जाता है ?
Answer – फास्फोरस (P)
Question 23. कौन सी अधातु चमकीली होती है ?
Answer – आयोडाइड (I)
Question 24. सुचालक अधातु कौन सी होती है ?
Answer – ग्रेफाइट
Question 25. सबसे अधिक कठोर अधातु कौन सी होती है ?
Answer – हीरा
Question 26. उभयधर्मी ऑक्साइड किसे कहते है ?
Answer – वे धातु ऑक्साइड जो अम्ल व क्षारक के के साथ अभिक्रिया करके लवण + जल प्रदान करते है उन धातु ऑक्साइडों को उभयधर्मी ऑक्साइड कहते है |
Question 27. धातु किसे कहते हैं ?
Answer – वे तत्व या परमाणु जो इलेक्ट्रॉन त्याग कर धनायन बनाते हैं धातु कहलाते हैं |
Question 28. एनोडीकरण किसे कहते है ?
Answer – एलुमिनियम पर मोटी ऑक्साइड की परत एलुमिनियम को संक्षारित होने से या जंग लगने से बचाती है उसे एनोडीकरण कहते हैं |
Question 29. कौनसी धातुएँ ठंडे जल के साथ अभिक्रिया करती है ?
Answer – सोडियम (Na) और पोटेशियम (K)
Question 30. कौनसी धातुएँ गर्म जल के साथ अभिक्रिया करती है ?
Answer – कैल्शियम (Ca) व मैग्नीशियम (Mg)
Important Question
Question 31. कौनसी धातुएँ भाप के साथ अभिक्रिया करती है ?
Answer – एल्युमीनियम (Al), जिंक (Zn), आयरन (Fe)
Question 32. एक्वारेजिया का निर्माण कैसे होता है ?
Answer – तीन भाग हाइड्रोक्लोरिक अम्ल (HCl) और एक भाग नाइट्रिक अम्ल (HNO3) मिलकर एक्वारेजिया का निर्माण करते हैं |
Question 33. ऑक्सीकरण संख्या किसे कहते है ?
Answer – किसी योगिक या अणु में किसी परमाणु पर उपस्थित आवेश की मात्रा को ऑक्सीकरण संख्या कहते हैं |
Question 34. क्षार धातुओं की ऑक्सीकरण संख्या कितनी होती है ?
Answer – +1
Question 35. क्षार मृदा धातुओं की ऑक्सीकरण संख्या कितनी होती है ?
Answer – +2
Question 36. हैलोजन की ऑक्सीकरण संख्या कितनी होती है ?
Answer – -1
Question 37. खनिज किसे कहते हैं ?
Answer – पृथ्वी की भूपर्पटी में प्राकृतिक रूप से पाए जाने वाले तत्व या यौगिक को खनिज कहते हैं |
Question 38. अयस्क किसे कहते हैं ?
Answer – वे खनिज जिनको कम लागत व आसानी से प्राप्त किया जा सकता है, इन खनिजों को अयस्क कहते हैं |
Question 39. गैंग किसे कहते हैं ?
Answer – पृथ्वी से खनित अयस्कों में मिट्टी, रेत आदि जैसी कई अशुदियां होती है, जिन्हें गैंग कहते हैं |
Question 40. सक्रियता श्रेणी किसे कहते हैं ?
Answer – धातुओं की क्रियाशीलता के आधार पर अवरोही क्रम में व्यवस्थित करने पर जो सूची प्राप्त होती है, उसे सक्रियता श्रेणी कहते हैं |
उपरोक्त पोस्ट में Chapter 3 धातु और अधातु Notes in Hindi Class 10th के बारे में विस्तृत जानकारी दी हुई है | इसके अतिरिक्त अगर आप विज्ञान के और भी अध्यायों का अध्यन करना चाहे तो आप हमारी वेबसाइट पर कर सकते है कुछ महत्वपूर्ण लिंक निचे दिए है |
Other Topic Important Links
Science More Important Topics you can click here
Hindi More Important Topics you can read here
Rajasthan GK More Important Topics click here
Psychology More Important Topics you can read here

